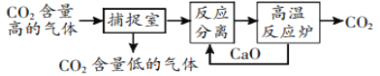
题目内容
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是

A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
【答案】A
【解析】
SO2与BaCl2反应产生沉淀,溶液中必须存在大量的SO32-,右侧Y型管中应能生成碱性气体或氧化性气体,若是碱性气体,溶液中存在大量的SO32-,若是氧化性气体,溶液中可生成SO42-,则生成的沉淀可能为BaSO3或BaSO4;容器内压强增大,溶液倒吸,气体不容易导入,所以导气管A的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入,由此分析解答。
A. 若是碱性气体,溶液中存在大量的SO32,所以e、f两管中的试剂可以分别是浓氨水和NaOH,产生氨气碱性气体,故A正确;
B. SO2与BaCl2不反应,氧化性气体将溶液中的亚硫酸根离子氧化成硫酸根离子,而不是将BaSO3氧化为BaSO4沉淀,故B错误;
C. 玻璃管的作用是连通大气,平衡压力,以便左右两边产生的气体顺利导入,故C错误;
D. 如果产生氨气,氨气极易溶于水,为防止倒吸,所以不能插入BaCl2溶液中,故D错误;
答案选A。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100 mL-1)。
Ⅰ.实验步骤
(1)配制待测白醋溶液,用____(填仪器名称)量取10.00 mL食用白醋,在____(填仪器名称)中用水稀释后转移到100 mL____(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。
(4)滴定。判断滴定终点的现象是____,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3~4次。
(5)如图是某次滴定时的滴定管中的液面,其读数为____mL。
![]()
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(6)按正确数据处理,得出c(市售白醋)=____mol/L,市售白醋总酸量=____g·100 mL-1。
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。
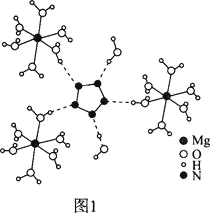
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示:
N、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
①X、Y、Z中为N元素的是____,判断理由是__________。
②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N4-中的大π键应表示为_________。
),则N4-中的大π键应表示为_________。
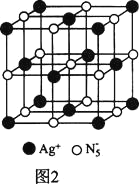
(3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为_____gcm-3(用含a、NA的代数式表示)。