题目内容
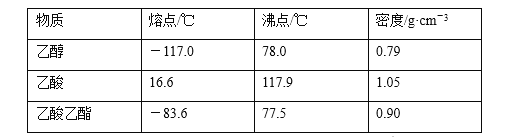
【题目】下表是25℃时某些弱酸额的电离平衡常数。

(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈______(填“酸性”、“碱性”或“中性”),该溶液中各离子浓度由大到小的顺序为_______。
(2)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=_______。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为________。
(4)若0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______mol/L(填精确计算结果)。
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度关系为______。
(6)已知某温度下,0.10mol/LNH4Cl溶液的pH=5,则该温度下NH3·H2O的电离常数约为________。
【答案】酸性 c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 5 2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3- 9.9×10-7 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ![]()
【解析】
(1)H2C2O4与含等物质的量的KOH的溶液反应后得到KHC2O4,结合草酸的电离平衡常数分析溶液酸碱性和溶液中离子浓度大小;
(2)根据醋酸的电离平衡常数=1.8×10-5,c(CH3COOH):c(CH3COO-)=5:9,求出溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
(3)根据酸性HCl>H2CO3>HClO>HCO3-,结合强酸可以制备弱酸分析;
(4)0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,恰好反应产生CH3COONa,结合电荷守恒及溶液的pH计算;
(5)先判断CO2和NaOH溶液反应的产物,然后根据水解来解答;
(6)设该温度下水的离子积为Kw,0.10mol/LNH4Cl溶液的pH=5,溶液中c(H+)=1.0×10-5mol/L,c(NH3·H2O)=1.0×10-5mol/L,则此时溶液中氢氧根离子浓度为:c(OH-)=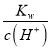 ,由于水解程度较小,则铵根离子浓度约为0.1mol/L,据此结合电离平衡常数的表达式列式计算。
,由于水解程度较小,则铵根离子浓度约为0.1mol/L,据此结合电离平衡常数的表达式列式计算。
(1)H2C2O4与等物质的量的KOH的溶液反应后得到KHC2O4,该盐是强碱弱酸盐,在溶液中HC2O4-发生电离作用:HC2O4-![]() H++C2O42-,根据表格数据可知Ka2=6.4×10-5,也存在水解作用:HC2O4-+H2O
H++C2O42-,根据表格数据可知Ka2=6.4×10-5,也存在水解作用:HC2O4-+H2O![]() H2C2O4+OH-,其水解平衡常数Kh=
H2C2O4+OH-,其水解平衡常数Kh=![]() <6.4×10-5,说明HC2O4-电离程度大于其水解程度,所以溶液显酸性;KHC2O4在溶液中发生电离:KHC2O4=K++HC2O4-,HC2O4-在溶液中既发生电离作用,也发生水解作用而消耗,所以c(K+)>c(HC2O4-),HC2O4-电离程度大于其水解程度。c(H+)>c(OH-),溶液中的H+既有HC2O4-电离产生,也有水电离产生,则c(H+)>c(C2O42-),HC2O4-电离程度大于其中水的电离程度,则c(C2O42-)>c(OH-),故该物质的水溶液中各种离子浓度大小关系为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)> c(OH-);
<6.4×10-5,说明HC2O4-电离程度大于其水解程度,所以溶液显酸性;KHC2O4在溶液中发生电离:KHC2O4=K++HC2O4-,HC2O4-在溶液中既发生电离作用,也发生水解作用而消耗,所以c(K+)>c(HC2O4-),HC2O4-电离程度大于其水解程度。c(H+)>c(OH-),溶液中的H+既有HC2O4-电离产生,也有水电离产生,则c(H+)>c(C2O42-),HC2O4-电离程度大于其中水的电离程度,则c(C2O42-)>c(OH-),故该物质的水溶液中各种离子浓度大小关系为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)> c(OH-);
(2)醋酸的电离平衡常数表达式K=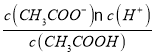 =1.8×10-5,而c(CH3COOH):c(CH3COO-)=5:9,则
=1.8×10-5,而c(CH3COOH):c(CH3COO-)=5:9,则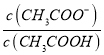 =9:5,所以
=9:5,所以![]() c(H+)=1.8×10-5,所以c(H+)=1.8×10-5mol/L,所以溶液的pH=5;
c(H+)=1.8×10-5,所以c(H+)=1.8×10-5mol/L,所以溶液的pH=5;
(3)由于酸性HCl>H2CO3>ClO>HCO3-,根据酸性强的可以制备弱酸弱的,所以向碳酸钠溶液中滴加少量氯水的离子方程式为2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-;
(4)0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应产生CH3COONa,该溶液pH=8,则c(H+)=10-8mol/L,根据水的离子积为10-14,则c(OH-)=10-6mol/L在溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L;
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,CO2与NaOH的物质的量之比=2:3,则CO2与NaOH都完全反应,所得产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:x+y=0.1,2x+y=0.15,联立方程解得x=y=0.05,所以产物为0.05molNa2CO3,0.05molNaHCO3,因CO32-水解,溶液呈碱性,溶液呈碱性,则c(OH-)>c(H+),盐水解程度较小,则c(HCO3-)>c(CO32-),水中OH-来源于CO32-、HCO3-水解及水的电离,水的电离程度很小,则为:c(CO32-)>c(OH-),所以溶液中离子浓度大小关系c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+);
(6)已知某温度下,0.10mol/LNH4Cl溶液的pH=5,溶液中c(H+)=1.0×10-5mol/L,c(NH3·H2O)=1.0×10-5mol/L,则此时溶液中氢氧根离子浓度为:c(OH-)=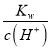 =
=![]() mol/L,由于水解程度较小,则c(NH4+)=0.1mol/L,则该温度下NH3·H2O的电离平衡常数K=
mol/L,由于水解程度较小,则c(NH4+)=0.1mol/L,则该温度下NH3·H2O的电离平衡常数K=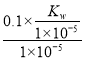 =
=![]() 。
。

【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
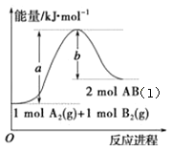
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
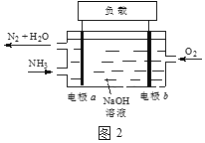
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________