题目内容
15.亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危 害.其在酸性条件下会产生NO和NO2.下列有关说法错误的是( )| A. | NaNO2既具有氧化性又具有还原性 | |
| B. | 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol | |
| C. | NaNO2和胃酸作用的离子方程式为:2NO${\;}_{2}^{-}$+2H+=NO↑+NO2↑+H2O | |
| D. | 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 |
分析 酸性条件下,亚硝酸钠会产生一氧化氮和二氧化氮,所以亚硝酸钠和胃酸作用的离子方程式为2NO2-+2H+═NO↑+NO2↑+H2O,N元素的化合价由+3价降低为+2价,N元素的化合价由+3价升高为+4价,以此来解答.
解答 解:A.N元素的化合价既升高又降低,则NaNO2既具有氧化性又具有还原性,故A正确;
B.1molNaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1mol×$\frac{1}{2}$×(4-3)=0.5mol,故B错误;
C.酸性条件下,亚硝酸钠会产生一氧化氮和二氧化氮,所以亚硝酸钠和胃酸作用的离子方程式为:2NO2-+2H+═NO↑+NO2↑+H2O,故C正确;
D.食用“醋溜豆芽”减少亚硝酸盐的含量,可能会减少亚硝酸钠对人体的危害,故D正确;
故选B.
点评 本题考查物质的性质及氧化还原反应,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.如图1是某煤化工产业链的一部分,试运用所学知识,解决下列问题:
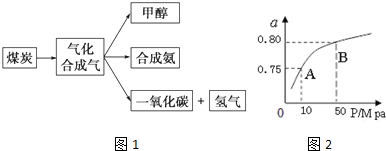
(1)已知该产业链中某反应的平衡常数表达式为K=$\frac{C({H}_{2}).C(CO)}{C({H}_{2}O)}$,它所对应反应的化学方程式是C(s)+H2O(g)?CO(g)+H2(g).
(2)合成甲醇的主要反应是2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,t℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
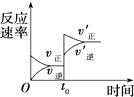
①该时间段内反应速率v(H2)=0.08mol•L-1•min-1.
②比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
③某温度下反应时H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B) (填“>”、“<”或“=”);
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中乙酸的电离常数为$\frac{2b×1{0}^{-7}}{a-2b}$.

(1)已知该产业链中某反应的平衡常数表达式为K=$\frac{C({H}_{2}).C(CO)}{C({H}_{2}O)}$,它所对应反应的化学方程式是C(s)+H2O(g)?CO(g)+H2(g).
(2)合成甲醇的主要反应是2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,t℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol•L-1) | 0.2 | 0.1 | 0.4 |
②比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
③某温度下反应时H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B) (填“>”、“<”或“=”);
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中乙酸的电离常数为$\frac{2b×1{0}^{-7}}{a-2b}$.
6.已知溶液中存在较大量的H+、SO42-、NO3-,则该溶液中还能大量共存的离子组为( )
| A. | Na+、CH3COO-、NH4+ | B. | Mg2+、Ba2+、Br- | ||
| C. | Cu2+、Cl-、I- | D. | K+、Cl-、Mg2+ |
10.下列说法正确的是( )
| A. | 1mol/L的NaCl溶液是指此溶液中含有1 mol NaCl | |
| B. | 从1L 0.5mo1/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1mol/L | |
| C. | 0℃时,1molC12的体积约为22.4L | |
| D. | 1mol/L的CaCl2溶液中,Cl-的物质的量浓度为2mol/L |
20.将钠、镁各0.1mol分别放入100ml 1mol•L-1硫酸中,同温同压下产生的气体体积比是( )
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
1.某生配制480ml 0.1mol/L的NaOH溶液,下列操作可使所配制的溶液的浓度偏大的是( )
| A. | 烧杯中溶液转移到容量瓶中时,未洗涤烧杯 | |
| B. | 移液时,有少量液体溅出 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容摇匀后发现液面下降,继续加水至刻度线 |
18.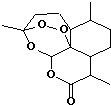 2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键-线结构简式如图.下列关于青蒿素的说法不正确的是( )
2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键-线结构简式如图.下列关于青蒿素的说法不正确的是( )
 2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键-线结构简式如图.下列关于青蒿素的说法不正确的是( )
2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键-线结构简式如图.下列关于青蒿素的说法不正确的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 可发生水解反应 | D. | 含有过氧键(-O-O-)有强氧化性 |
19.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 常温下,23g NO2和N2O4的混合气体含有NA个氧原子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |