题目内容
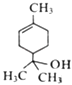
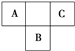
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。下列有关说法正确的是
A. A、C的氢化物的沸点都是同族元素中最低的
B. 三种元素的最高化合价分别与其主族序数相等
C. 原子半径:B >A>C
D. 非金属性:C>B,C单质能从B的氢化物水溶液中置换出B
【答案】C
【解析】在元素周期表中,A、B、C为短周期元素,由图可知,A、C处在第二周期,B处在第三周期。第二、三周期上下相邻元素的原子序数相差8。A、C两元素的原子核外电子数之和等于B原子的质子数,表明B是16号元素硫,相应地A、C分别是氮、氟。A. A、C的氢化物含有氢键,它们的沸点都是同族元素中最高的,故A错误;B. 氟元素只有-1价,故B错误;C. 同周期元素原子半径从左到右逐渐减小,所以原子半径:A>C,B原子电子层数与A、C相差较大,所以原子半径:B>A>C,故C正确;D. C单质非金属性极强,遇水剧烈反应,所以C单质不能从B的氢化物水溶液中置换出B,故D错误。故选C。

【题目】恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)2HN3(g),并达到化学平衡,根据表中数据回答有关问题
物质的量浓度 | N2 | H2 | NH3 |
起始/molL﹣1 | a | 6 | 0 |
转化/molL﹣1 | b | c | d |
平衡/molL﹣1 | 1 | e | 3 |
(1)表中a= , e=
(2)若反应经3min达到平衡,则反应速率v(N2)=molL﹣1min﹣1;
(3)该反应体系的起始状态与平衡状态的压强之比为;
(4)上述反应过程中,如果降低温度,则反应速度(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.