��Ŀ����
����Ŀ���ƺ��ƵĻ���������Ҫ�����
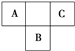
��1����һС���Ʒ���ˮƽ���õ��Թ��в����þƾ��Ƽ��ȳ�ַ�Ӧ(��ͼ����ʾ)����д���÷�Ӧ�Ļ�ѧ����ʽ____________�����������ɫΪ____�������Թ���ȴ��ֱ�����μӼ���ˮ(��ͼ����ʾ)��������Ӧ�����ӷ���ʽΪ____________������÷�Ӧ����������ķ�����________________��
��2�������ͬ���壬����祿��仯�������ʵ��ƶ���ȷ����_________________________������ţ���
��蘆��۵���Ƶĸ� �����������Ӧֻ����Se2O ��SeOH�ļ��Ա�KOHǿ ��爐��ܴ�FeCl3��Һ���û����� ��SeCl��ˮ��Һ������
��3��ij��ɫϡ��Һ�������ܺ���Al3����Cl����Fe3����Mg2����NH![]() �е�ij���֣������м���NaOH��Һʱ�������������ʵ���(n)�����NaOH��Һ���(V)�Ĺ�ϵ����ͼ��ʾ��
�е�ij���֣������м���NaOH��Һʱ�������������ʵ���(n)�����NaOH��Һ���(V)�Ĺ�ϵ����ͼ��ʾ��
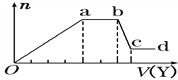
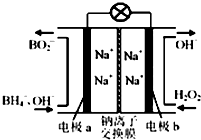
��X��һ�����е���������______________________________��ab�η�Ӧ�����ӷ���ʽΪ____________________��
���𰸡� 2Na��O2![]() Na2O2 ����ɫ 2Na2O2��2H2O=4Na����4OH����O2�� �ô�����ľ�������Ƿ�ȼ �ۢܢ� Al3����Mg2����NH4�� NH4����OH��=NH3��H2O
Na2O2 ����ɫ 2Na2O2��2H2O=4Na����4OH����O2�� �ô�����ľ�������Ƿ�ȼ �ۢܢ� Al3����Mg2����NH4�� NH4����OH��=NH3��H2O
����������1�����������ڼ��ȵ����������ɹ������ƣ�����ʽΪ��2Na��O2![]() Na2O2��Na2O2Ϊ����ɫ���塣Na2O2��H2O��Ӧ����NaOH��O2�����ӷ���ʽ�������ﲻ�ɲ��������ӷ���ʽΪ��2Na2O2��2H2O=4Na����4OH����O2�����������������ô����ǵ�ľ�������Ƿ�ȼ��
Na2O2��Na2O2Ϊ����ɫ���塣Na2O2��H2O��Ӧ����NaOH��O2�����ӷ���ʽ�������ﲻ�ɲ��������ӷ���ʽΪ��2Na2O2��2H2O=4Na����4OH����O2�����������������ô����ǵ�ľ�������Ƿ�ȼ��
�ʴ�Ϊ��2Na��O2![]() Na2O2������ɫ��2Na2O2��2H2O=4Na����4OH����O2����
Na2O2������ɫ��2Na2O2��2H2O=4Na����4OH����O2����
�ô�����ľ�������Ƿ�ȼ��
��2�������ͬ���壬������������ʼ���ѧ���ʾ����ڵݱ��Ժ������ԡ�ͬ����Ԫ�أ��������£��������ʵ��۵����ͣ��ʢٴ���Ԫ�ؽ���������ǿ����������Ӧ�����Խ��Խ���ӣ�����������Ӧ����Na2O��Na2O2�����������Ӧ�����ӣ��ʢڴ���������ǿ��������������ˮ�������Ҳ����ǿ���ʢ���ȷ����������Һ����ˮ���ҷ�Ӧ�������û�������������櫓��Ƹ����ã�������Һ��ҲӦ��ˮ���ҷ�Ӧ�����ܹ������û��������ʢ���ȷ��NaCl��Һ�����ԣ�ͬ����SeClҲΪǿ�������Σ�ˮ��ҺΪ���ԣ��ʢ���ȷ��
�ʴ�Ϊ���ۢܢݣ�
��3����ҺΪ��ɫ�����ų�����ɫ��Fe3��������Һ�м���NaOH�����������������������������ܽ⣬����Һ�к���Al3����Mg2����a-b�μ�NaOH��û�г�����������NaOH����NH4+����Һ�д���NH4+������Ϊ��Һ�ش�ʵ����ԣ�����һ���������룬����ֻ��Cl����
�ʴ�Ϊ��Al3����Mg2����NH4����NH4����OH��=NH3��H2O��