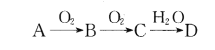题目内容
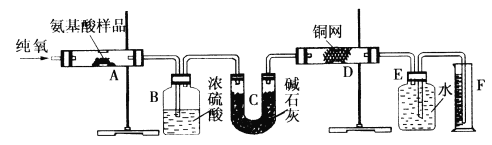
【题目】我国《食品添加剂使用卫生标准》中规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
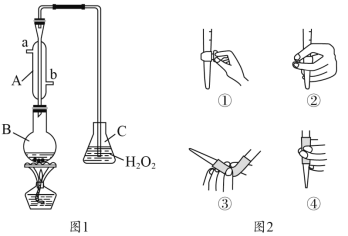
(1)仪器B的名称是__________,冷却水的进口为________。(填“a”或“b”)
(2)B中加入300.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________。
(3)除去C中过量的H2O2,然后用0.1000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若选择酚酞为指示剂,则滴定终点的现象为_____________________;
(4)经3次平行实验,消耗NaOH溶液体积如下:
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
该葡萄酒中SO2含量为______________g·L-1(保留两位小数)。
【答案】圆底烧瓶(答烧瓶也给满分) b SO2+H2O2=H2SO4 ③ 当滴入最后一滴标准液,溶液由无色变为粉红色,且半分钟内不褪色 0.21
【解析】
(1)根据仪器B的形状确定仪器名称,冷凝管中通水方向采用下进上出;
(2)二氧化硫具有还原性,能够与双氧水反应生成硫酸,据此写出反应的离子方程式;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,根据碱式滴定管确定排气泡的方法;滴定终点时溶液显碱性酸碱性,据此判断滴定终点的现象;
(4)第3次滴定误差明显偏大,根据实验1、2计算消耗标准液的体积的平均值,再根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,最后计算出该葡萄酒中的二氧化硫含量。
(1)根据图示,仪器B为圆底烧瓶,冷凝管中通水方向采用下进上出,所以进水口应该为b,故答案为:圆底烧瓶;b;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,故答案为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法为:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液显弱碱性,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0),滴定终点现象为:当滴入最后一滴烧碱溶液时,溶液由无色变为粉红色,且半分钟不褪色,故答案为:③;当滴入最后一滴烧碱溶液时,溶液由无色变为粉红色,且半分钟不褪色;
(4)第3次滴定误差明显偏大,则选择实验1、2计算消耗标准液的体积的平均值,即消耗标准液的体积V=![]() mL=20.00mL,根据2NaOH~H2SO4~SO2可知SO2的质量为
mL=20.00mL,根据2NaOH~H2SO4~SO2可知SO2的质量为![]() ×0.1000mol/L×0.020L×64g/mol=0.064g,该葡萄酒中的二氧化硫含量为
×0.1000mol/L×0.020L×64g/mol=0.064g,该葡萄酒中的二氧化硫含量为![]() =0.21g/L,故答案为:0.21。
=0.21g/L,故答案为:0.21。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】我国政府承诺,到2020年,单位GDP CO2排放量比2005年下降40%-45%。请回答下列问题:
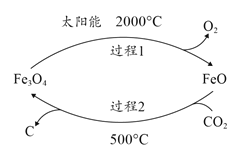
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,其流程如上图所示。该循环中Fe3O4可视为_______(填“催化剂”、“中间产物”),过程2捕获1mo1CO2转移电子的物质的量是_______mol。
(2)以CO2和NH3为原料合成尿素[CO(NH2)2],反应如下:
2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-1595kJ·mol-1
H2NCOONH4 (s)=CO(NH2)2(s)+H2O(g) ΔH=+1165kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
CO2(g)与NH3(g)合成尿素和液态水的热化学方程式_______________________;
(3)CH4-CO2催化重整可以得到燃料CO和H2。一定条件下在恒容的密闭容器中发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
A.CO2和CH4的浓度相等
B.v正(CO2)=2v逆(CO)
C.每断裂4molC—H键的同时,断裂2molH—H键
D.容器中混合气体的平均相对分子质量保持不变
E.容器中混合气体的密度保持不变
(4)CO2是一种温室气体,但其本身无毒,处理废气时常将一些有毒物质转化为CO2。一定温度下,在三个容积均为2.0 L的密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
不同温度下,容器中各物质起始和平衡时的物质的量如下表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡时物质的量/mol | |
NO(g) | CO(g) | CO2 | ||
甲 | 50 | 0.2 | 0.2 | 0.12 |
乙 | 100 | 0.2 | 0.2 | 0.1 |
丙 | 100 | 0.3 | 0.3 | |
下列说法正确的是___________
A.该反应的正反应为吸热反应
B.50℃时,若起始时向甲中充入0.1 mol N2和0.2 mol CO2,则达平衡时N2的转化率为40%
C.100℃时,若起始时向乙中充入的NO、CO、N2和CO2均为0.40 mol,则此时v正>v逆
D.达到平衡时,丙中CO2的体积分数比乙中的小