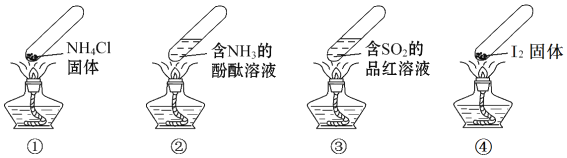
题目内容
【题目】利用来源丰富、含碳原子数较少的烃为原料合成性能优良的高分子材料具有现实意义。以甲烷和烃C合成两种高分子材料B与F(F为聚酯类高分子化合物)的路线如图:
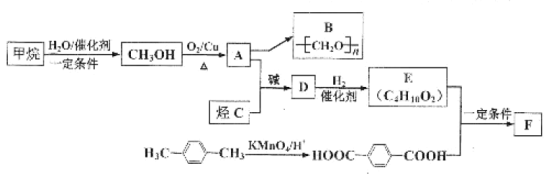
已知:①H-C![]() C-H+2
C-H+2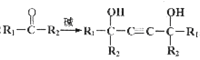 ;
;
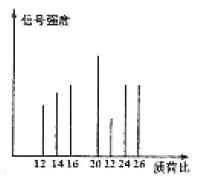
②烃C的质谱图如图所示:
请回答下列问题:
(1)有机物A→B的反应类型是__(填“加聚”或“缩聚”)反应;烃C的结构简式为___。
(2)![]() 的化学名称为___,与其互为同分异构的芳香烃还有___种。
的化学名称为___,与其互为同分异构的芳香烃还有___种。
(3)有机物D中所含官能团名称为____
(4)写出D转化为E的化学方程式_____
(5)F的结构简式为__,若F的平均相对分子质量为10000,则其平均聚合度约为___(填字母标号)。
a.45 b.56 c.66 d.69
(6)参照以上合成路线,以烃C和溴乙烷为有机原料(无机试剂任选),设计制备有机化合物H3C-CH(OH)-C≡C-CH(OH)-CH3的合成路线:___
【答案】加聚; CH![]() CH 对二甲苯 3 羟基,碳碳三键,
CH 对二甲苯 3 羟基,碳碳三键, ![]()
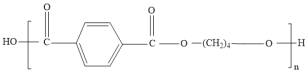 ; a
; a ![]() H3C-CH(OH)-C≡C-CH(OH)-CH3
H3C-CH(OH)-C≡C-CH(OH)-CH3
【解析】
此题通过甲烷和水发生加成反应制取甲醇,甲醇经过催化氧化变成甲醛,B时甲醛加聚反应的产物,再通过已知所给的方程式转化方法,来制取D,由于D中含有三键,所以利用氢气加成制取E,再通过E和对二苯甲酸的缩聚反应制取高分子材料F。
(1)根据分子式的变化得出,A→B的反应类型是加聚反应;根据质谱法图像得出C时丙炔,结构简式为CH![]() CH;
CH;
(2)![]() 的化学名称为对二甲苯;与其互为同分异构的芳香烃还有3种,分别为两个甲基处于邻位,对位,以及甲基都在一条支链上;
的化学名称为对二甲苯;与其互为同分异构的芳香烃还有3种,分别为两个甲基处于邻位,对位,以及甲基都在一条支链上;
(3)D中所含官能团名称为羟基和碳碳三键;
(4)D转化为E为加成反应,方程式为:![]() ;
;
(5)F的结构简式为 ,F中重复的部分相对分子质量为220,所以
,F中重复的部分相对分子质量为220,所以![]() ,则其平均聚合度约为45;
,则其平均聚合度约为45;
(6)根据所要制取有机物的结构,推断出应该先发生水解反应制取醇羟基,随后根据已知的化学反应,合成目标有机物,合成路线为![]() H3C-CH(OH)-C≡C-CH(OH)-CH3。
H3C-CH(OH)-C≡C-CH(OH)-CH3。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
Al_____Si | N____O | 金刚石_____晶体硅 | CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
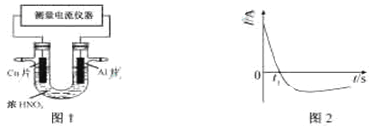
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是___;C元素在元素周期表中的位置是___;甲的电子式是___。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是___;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈___(填“酸”或“碱”)性,用电离方程式表示其原因是___。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试是___。
②A、C组成的化合物中,化学式为C2A6,该物质与D的单质发生反应的类型___,写出其中一个化学方程式是___。