题目内容
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
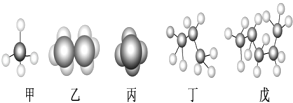
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是___;C元素在元素周期表中的位置是___;甲的电子式是___。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是___;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈___(填“酸”或“碱”)性,用电离方程式表示其原因是___。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试是___。
②A、C组成的化合物中,化学式为C2A6,该物质与D的单质发生反应的类型___,写出其中一个化学方程式是___。
【答案】H 第二周期第IVA族 ![]() Cl2+H2O=H++Cl-+HClO 碱 .NaOH=Na++OH- Br2的CCl4溶液 取代反应 C2H6+Cl2→C2H5Cl+HCl
Cl2+H2O=H++Cl-+HClO 碱 .NaOH=Na++OH- Br2的CCl4溶液 取代反应 C2H6+Cl2→C2H5Cl+HCl
【解析】
四种短周期元素A、B、C、D,信息②中四种元素之间形成甲、乙、丙三种分子,甲分子为V型结构,是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,故甲为H2O,乙为正四面体结构,无色无味而易燃,是常见的一种基础能源,乙为CH4,丙分子有3个不同的原子,具有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A<B<C<D可得,A为H元素、B为O元素、C为C元素、D为Cl元素。
由分析知:A为H元素、B为O元素、C为C元素、D为Cl元素;甲为H2O、乙为CH4、丙为HClO;
(1)A的元素符号是H;C为碳元素,在元素周期表中的位置是:第二周期IVA族,甲为H2O,电子式是:![]() ;
;
(2)丙(HClO)可由D(Cl)元素的单质与物质甲反应得到,该反应的离子方程式是Cl2+H2O=H++Cl-+HClO;D(Cl)所在周期中,E元素的单质还原性最强,而E为Na,则E的单质与甲(水)反应生产NaOH溶液,发生电离:NaOH=Na++OH-,溶液呈碱性;
(3)①由H、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则丁为乙烯,在实验室中利用Br2的CCl4溶液可除去甲烷中混有的少量乙烯;
②化学式为C2H6,为乙烷,在光照条件下,能与Cl2发生取代反应,其中生成CH3CH2Cl的化学方程式是CH3CH3+Cl2![]() C2H5Cl+HCl。
C2H5Cl+HCl。

 开心蛙状元测试卷系列答案
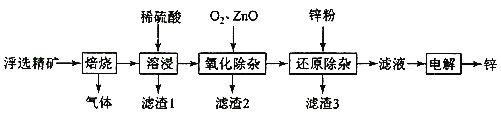
开心蛙状元测试卷系列答案【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
请回答下列问题:
(1)焙烧过程中产生的气体化学式__。
(2)溶浸时,提高浸出率的方法有____。(至少写出两种)
(3)利用Fe(OH)3悬浊液与含SO2的烟气反应生成FeSO4,可以使烟气脱硫,该反应的离子方程式为__。产物FeSO4在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__。
(4)氧化除杂时,加入ZnO调节溶液pH,当用广泛pH试纸测得pH值为___时,可认为已达除杂目的。
A.2 B.2.8 C.4 D.6.2
(5)滤渣3成分为______。
(6)若将闪锌矿直接浸入稀硫酸,要使0.10 molZnS完全溶于1LH2SO4(发生反应ZnS+H2SO4 =ZnSO4+H2S),则需H2SO4的最低浓度为___。(Ksp[ZnS]=2.5×10-22,H2S的K1=1×10-7,K2=1×10-14,忽略反应前后液体体积变化)