题目内容
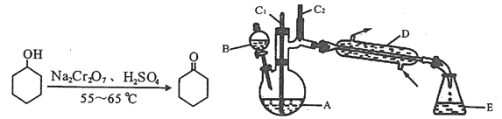
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如图:
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液___;
②蒸馏不能分离环己酮和水的原因是___。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是___;
②b中水层用乙醚萃取的目的是___;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__,操作d中,加入NaCl固体的作用是__。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为__。
【答案】冷凝管 打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加 环己酮和水形成具有固定组成的恒沸物一起蒸出 dbeca 使水层中少量的有机物进一步被提取,提高产品的产量 漏斗、分液漏斗 降低环己酮的溶解度,増加水层的密度,有利于分层 60.6%
【解析】
本实验的目的是制备环己酮,装置A中利用酸性Na2Cr2O7溶液将环己醇在55 ~ 65℃时氧化得到环己酮,反应完成后,加入适量水,蒸馏,收集95 ~ 100C的馏分,得到主要含环己酮粗品和水的混合物;之后进行提纯,首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮。
(1)装置D的名称是冷凝管,具有冷凝蒸汽作用;
(2)①由于酸性Na2Cr2O7溶液氧化环己醇反应剧烈,导致体系温度迅速上升、副反应增多,所以酸性Na2Cr2O7溶液加入不能太快,应打开分液漏斗颈上的玻璃塞,拧开下端的活塞,缓慢滴加;
②由于环己酮和水形成具有固定组成的恒沸物,环己酮和水会一起蒸出,导致蒸馏不能分离环己酮和水;
(3)①环己酮的提纯:首先往液体中加入NaCl固体至饱和,从而降低环己酮的溶解度,并且增加水层的密度,静置后分液;分液后水层用乙醚萃取进一步提取水层中环己酮并入有机层;之后用无水硫酸镁除去有机物中少量的水分,过滤后蒸馏分离乙醚,得到纯净的环己酮,所以,提纯步骤的正确顺序是dbeca;
②环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚微溶于水,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量;
③过滤需要由漏斗组成的过滤器,分液需要的主要仪器为分液漏斗;NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;
(4) 环己醇的质量为10mL×0.96g/mL=9.6g,理论上得到环己酮质量=![]() ×98g/mol=9.408g,恢复至室温时,分离得到纯产品体积为6mL,由表中的密度可以算出环己酮的实际质量为0.95g/mL×6mL=5.7g,所以环己酮的产率为:
×98g/mol=9.408g,恢复至室温时,分离得到纯产品体积为6mL,由表中的密度可以算出环己酮的实际质量为0.95g/mL×6mL=5.7g,所以环己酮的产率为:![]() =60.6%。
=60.6%。

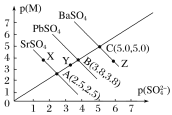
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是
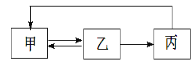
甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D