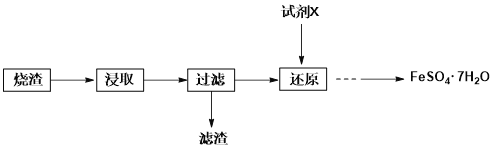
题目内容
【题目】t℃时,100mLNaNO3饱和溶液的质量为137g,如将这些溶液蒸干,获得62.5g NaNO3固体。下列说法中,不正确的是
A. t℃时,NaNO3饱和溶液密度为1.37g/cm3
B. t℃时,NaNO3的溶解度约为83.9g
C. t℃时,NaNO3饱和溶液中溶质的质量分数约为45.6%
D. t℃时,NaNO3饱和溶液中溶质的物质的量浓度约为1.61mol/L
【答案】D
【解析】
A.溶液的体积是100mL,溶液的质量是137g,所以根据密度定义式可得溶液的密度为![]() g/mL=1.37g/cm3,A正确;
g/mL=1.37g/cm3,A正确;
B.饱和溶液的质量为137g,溶质质量是62.5g,溶剂质量是m(溶剂)=137g-62.5g=74.5g,根据溶解度的概念可知,在100g溶剂中形成饱和溶液时溶解的溶质质量为S,则100:74.5=S:62.5,解得S=83.9g,B正确;
C.饱和溶液的质量为137g,溶质质量是62.5g,则该饱和溶液中溶质的质量分数为![]() 45.6%,C正确;
45.6%,C正确;
D.溶质质量是62.5g,则溶质的物质的量是n(NaNO3)=![]() ,由于溶液的体积为100mL,所以溶液的物质的量浓度为c=
,由于溶液的体积为100mL,所以溶液的物质的量浓度为c=![]() ,D错误;
,D错误;
故合理选项是D。

【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度