��Ŀ����
����Ŀ��CO2��ȼ�պʹ�л�����ղ��Ҳ���������ЧӦ�ķ�������CO2��Ϊһ����Դ�����������õ�ǰ��ʮ�����ˡ�
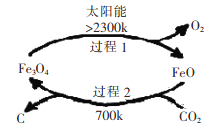
I������̫���ܣ���CO2Ϊԭ����ȡ̿�ڵ���������ͼ��ʾ������2�Ļ�ѧ����ʽΪ��__________��
II�������ѧ���������ɫ���������롣�Ѻ��д���CO2�Ŀ�������K2CO3��Һ�У��ٰ�CO2����Һ����ȡ��������ʹ֮��H2��Ӧ��ȡ�״����乤��������ͼ��ʾ��

��1���������ճص���ֽ���е���Ҫ���ʵĻ�ѧʽ��____________��
������������____________���ѧʽ����ѭ��ʹ�ã�����������������ɫ��ѧ�����
��2����ͬ�¶��£���1L�����ܱ������г���2mol CO2��5 mol H2����ͬʱ���ڲ��CO2��ת�������¶ȱ仯����ͼ��ʾ��

�ٺϳ����з����Ļ�ѧ��Ӧ����ʽΪ____________��
��T1ʱa��v������____________v���棩������>������<������=����
�ۼ����¶�ΪT4ʱb��ƽ�ⳣ��Ϊ____________��
��3��Ϊ�������ճ��б���K2CO3��Һ�Ƿ���㣬��ȡl00mL����Һ��0.10 mol./L����ζ������ɵ�V(CO2)����״���£���V�����ᣩ�仯��ϵ��ͼ��ʾ��

���l00mL����Һ�������ձ�״����_______mLCO2.
III����ϡ����Ϊ�������Һ�����Բ���Ϊ�缫������̫���ܽ�CO2ת��Ϊ��̼ϩ��������ԭ������ͼ��ʾ��

��1��H+���ƶ�������_______________����������һ����������
��2��������ϩ�ĵ缫��ӦʽΪ_______________��
���𰸡� 6FeO+CO2![]() C+2 Fe3O4 KHCO3 K2CO3 CO2+3H2
C+2 Fe3O4 KHCO3 K2CO3 CO2+3H2![]() CH3OH+ H2O > 800 56 �������� 2CO2+12H++ 12e-=C2H4+4H2O
CH3OH+ H2O > 800 56 �������� 2CO2+12H++ 12e-=C2H4+4H2O
��������������Ҫ�����йض�����̼�����ʡ�
I������2�Ļ�ѧ����ʽΪ��6FeO+CO2![]() C+2Fe3O4��
C+2Fe3O4��
II����1���ٷֽ���в���CO2�������ճص���ֽ���е���Ҫ���ʵĻ�ѧʽ��KHCO3��
������������KHCO3�ֽ����K2CO3������K2CO3���ѧʽ����ѭ��ʹ�ã�����������������ɫ��ѧ�����
��2���ٺϳ����з�����Ӧ�Ļ�ѧ����ʽΪCO2+3H2![]() CH3OH+H2O��
CH3OH+H2O��
��T1ʱa��ƽ����������Ӧ������������v������>v���棩��
���¶�ΪT4ʱb���ƽ��Ũ�ȣ�c(CO2)=(2-1.6)mol/L=0.4mol/L��c(H2)=(5-4.8)mol/L=0.2mol/L��c(CH3OH)=c(H2O)=1.6mol/L��ƽ�ⳣ��Ϊ![]() =800��
=800��
��3��V(����)��25mLʱ,������Ӧ��K2CO3+HCl![]() KCl+KHCO3��n(K2CO3)= n(HCl)=0.10mol/L��25mL=2.5mmol��K2CO3+H2O+CO2
KCl+KHCO3��n(K2CO3)= n(HCl)=0.10mol/L��25mL=2.5mmol��K2CO3+H2O+CO2![]() 2KHCO3,���l00mL����Һ��������2.5mmol����״����56mLCO2.
2KHCO3,���l00mL����Һ��������2.5mmol����״����56mLCO2.
III�� ��1��CO2������ԭ��Ӧ��ͨ��CO2��һ��������������������������H+���ƶ������Ǵ���������
��2��������ϩ�ĵ缫��ӦʽΪ2CO2+12H++12e-=C2H4+4H2O��