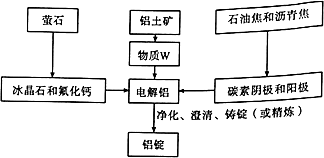
题目内容
12.下列各组化学方程式中,Q1<Q2的是( )| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-Q1kJ/mol CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H=-Q2kJ/mol | |
| B. | S(s)+O2(g)═SO2(g)△H=-Q1kJ/mol S(g)+O2(g)═SO2(g)△H=-Q2kJ/mol | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol | |
| D. | HCl(aq)+NaOH(aq)═+NaCl(aq)+H2O(I)△H=-Q1kJ/mol CH3COOH(aq)+NaOH(aq)═CH3COOHNa(aq)+H2O(l)△H=-Q2kJ/mol |
分析 A.等量物质完全燃烧放出的热量多;
B.等量物质气态时具有的能量多;
C.Cl2比Br2活泼,Cl-Cl键能较大,放出的热量更多;
D.弱酸电离时要吸收热量.
解答 解:A.等量物质完全燃烧放出的热量多,则甲烷完全燃烧生成二氧化碳时放出的热量多,即Q1>Q2,故A错误;
B.等量物质气态时具有的能量多,则气态硫具有的能量多,所以燃烧后气态硫放出的热量多,即Q1<Q2,故B正确;
C.Cl2比Br2活泼,Cl-Cl键能较大,则氯气与氢气反应放出的热量更多,所以Q1>Q2,故C错误;
D.弱酸电离时要吸收热量,醋酸与氢氧化钠反应生成1mol水放出热量小于57.3kJ,而盐酸与氢氧化钠反应生成1mol水放出热量为57.3kJ,所以Q1>Q2,故D错误.
故选B.
点评 本题考查了反应热大小比较,注意根据物质的状态、物质的稳定性来判断反应放热多少,题目难度不大.

练习册系列答案
相关题目
5.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)金属性最强的是Na,化学性质最不活泼的是Ar.
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(3)⑧的原子结构示意图为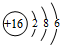 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
(4)若要证明非金属性:⑨>碘,可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为变蓝,即可证明.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(3)⑧的原子结构示意图为
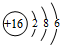 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.(4)若要证明非金属性:⑨>碘,可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为变蓝,即可证明.

20.下列描述中正确的是( )
| A. | ClO3-的空间构型为平面三角形 | |
| B. | SiF4 和 SO32-的中心原子均为 sp3 杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH 分子中共含有 8 个极性键,1 个 π 键 |
7.以下物质间的转化通过一步反应不能实现的是( )
| A. | Al2O3→Al(OH)3 | B. | Fe→FeCl2 | C. | S→SO2 | D. | Na→Na2O |
17.在一定温度下,用蒸馏水稀释醋酸溶液,随着醋酸浓度的降低,下列始终保持增大趋势的量的是( )
| A. | c(H+) | B. | H+个数 | C. | CH3COOH分子数 | D. | c(H+)/c(CH3COOH) |
4.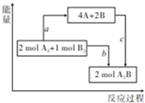 已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
 已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )| A. | a=1370kJ | |
| B. | 该反应是吸热反应 | |
| C. | A、B原子更易结合生成A2B | |
| D. | 反应的能量转化形式,由化学能转化为热能 |
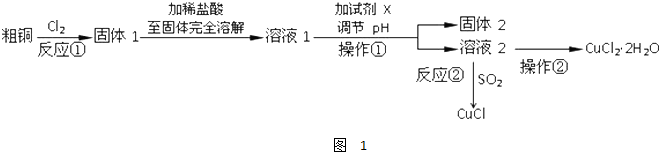

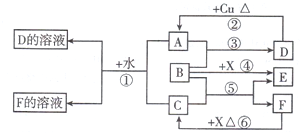
 .根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).
.根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).