题目内容
1.A-F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性,F的浓溶液与X其热通常用于实验室制备单质C,X是一种黑色粉末,这些物质之间满足如下图所示的转化关系,图中部分生成物已略去.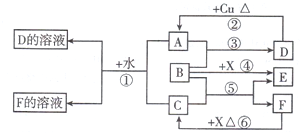
(1)写出下列物质的化学式:ASO2
(2)B的电子式是
 .根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).
.根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).(3)反应⑥的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)在反应⑥中,F表现的性质是还原性、酸性,当生成0.75mol C时,被氧化的还原剂的物质的量是1.5mol.
分析 B、D为液体,其中B的分子为4原子分子,因此B是H2O2,D在常温下不具有挥发性,且D能和铜反应,这说明D应该是H2SO4,则根据A是气体可知A是SO2,F的浓溶液与X共热通常用于实验室制备单质C,且C、E、F为气体,由于H2O2易分解生成O2,这说明E应该是O2,则X就是MnO2,所以C是Cl2,F是HCl,结合对应物质的性质以及题目要求可解答该题.
解答 解:B、D为液体,其中B的分子为4原子分子,因此B是H2O2,D在常温下不具有挥发性,且D能和铜反应,这说明D应该是H2SO4,则根据A是气体可知A是SO2,F的浓溶液与X共热通常用于实验室制备单质C,且C、E、F为气体,由于H2O2易分解生成O2,这说明E应该是O2,则X就是MnO2,所以C是Cl2,F是HCl,
(1)由以上分析可知A为SO2,
故答案为:SO2;
(2)B是H2O2,为共价化合物,电子式为 ,根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2,
,根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2,
故答案为: ;MnO2>Cl2>H2O2;
;MnO2>Cl2>H2O2;
(3)反应⑥是实验室制取氯气,反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)在实验室制取氯气的反应中,浓盐酸表现出的性质是还原性和酸性,根据氯原子守恒可知,当生成0.75mol 氯气时,被氧化的还原剂的物质的量是0.75mol×2=1.5mol,
故答案为:还原性、酸性;1.5 mol.
点评 本题是高考中的常见题型,试题贴近高考,难易适中,综合性强,有助于培养学生的逻辑思维能力和发散思维能力.化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等.

(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-Q1kJ/mol CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H=-Q2kJ/mol | |
| B. | S(s)+O2(g)═SO2(g)△H=-Q1kJ/mol S(g)+O2(g)═SO2(g)△H=-Q2kJ/mol | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol | |
| D. | HCl(aq)+NaOH(aq)═+NaCl(aq)+H2O(I)△H=-Q1kJ/mol CH3COOH(aq)+NaOH(aq)═CH3COOHNa(aq)+H2O(l)△H=-Q2kJ/mol |
| A. | 向漂白粉溶液中通入少量SO2:Ca2++2ClO-+2H2O+SO2═CaSO3↓+2HClO | |
| B. | 实验室用石灰石制备CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 向NH4HCO3溶液中加入足量稀NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | 向NaOH溶液中通入少量Cl2:Cl2+2OH-═ClO-+Cl-+H2O |
| A. | 乙醇和乙酸都存在碳氧双键 | |
| B. | 乙烯可以与氢气发生加成反应,也可以发生自身加聚反应生成聚氯乙烯 | |
| C. | 高锰酸钾可以氧化苯和甲烷 | |
| D. | 甲烷和乙烯都可以与氧气反应 |
| A. | 1 L 2 mol•L-1的NH4Cl溶液中含有的NH4+数目为2NA | |
| B. | 标况下,0.1mol苯中含有C=C键数目为0.3NA | |
| C. | 常温常压下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
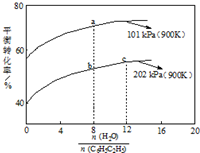 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)?C6H5CH=CH2(g)+H2(g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )| A. | a、b两点转化率不等,但是化学平衡常数相等 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{3}$ | |
| C. | 恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 | |
| D. | b点和c点温度和压强相同,故其反应速率也相等 |
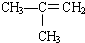 ⑥
⑥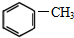 ⑤
⑤