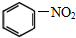
题目内容
20.下列描述中正确的是( )| A. | ClO3-的空间构型为平面三角形 | |
| B. | SiF4 和 SO32-的中心原子均为 sp3 杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH 分子中共含有 8 个极性键,1 个 π 键 |
分析 A.根据价层电子对互斥理论确定其分子空间构型,价层电子对个数=σ 键个数+孤电子对个数,据此判断其空间构型;
B.sp3杂化的中心原子的价层电子对的数目是4;
C.同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低;
D.碳碳键位非极性共价键,碳氢键为极性共价键,碳氧键为极性共价键,氢氧键为极性共价键,双键中含有1个σ键1个π键,三键中含有1个σ键2个π键.
解答 解:A.ClO3-中Cl原子形成3个δ键,孤电子对数为$\frac{7+1-3×2}{2}$=1,应为三角锥形离子,故A错误;
B.SiF4中Si原子的价层电子对为4+$\frac{4-4}{2}$=4,中心原子的杂化方式为sp3杂化,SO32-中S原子的价层电子对为$\frac{6+2}{2}$=4,中心原子的杂化方式为sp3杂化,故B正确;
C.稀有气体的原子结构是稳定结构,同周期稀有气体的第一电离能最大,同族自上而下第一电离能降低,故氦元素的第一电离能最大,故C错误;
D.C2H5OH分子中共含有5个碳氢极性共价键、1个碳氧极性共价键和1个氢氧极性共价键,所以含有7个极性共价键,含1个碳碳非极性共价键,无π 键,故D错误;
故选B.
点评 本题考查微粒空间构型的判断、第一电离能的变化规律、乙醇分子结构等,根据价层电子对互斥理论来分析、注意同周期主族元素能级处于半满、全满的稳定特殊情况第一电离能增大的特殊情况,题目难度中等.

练习册系列答案
相关题目
14.将标准状况下3.36L HCl溶于水配成25mL溶液,现用此盐酸与19.5g锌粒反应制取氢气.试计算:(写出计算过程)
(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
(1)此盐酸的物质的量浓度;
(2)若要使锌完全反应,则所需盐酸的最小体积.
8.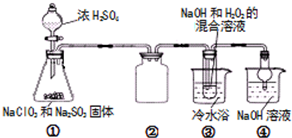 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
完成下列填空:
(1)组装好仪器后,检查装置气密性的操作是关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好.
(2)装置①中用NaClO3、Na2SO3和浓H2SO4反应制得ClO2,写出该反应的化学方程式2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O,装置③发生反应的离子方程式为2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑.
(3)装置③反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:
①50℃左右蒸发结晶;
②趁热过滤;
③用50℃左右的温水洗涤;
④低于60℃干燥,得到成品.
步骤③中用50℃左右的温水洗涤的原因是防止产生NaClO2•3H2O晶体.
(4)①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.
②取25.00mL待测液,用2.0mol•L-1Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入最后一滴Na2S2O3时,溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
(5)在实验过程中,下列操作会使实验结果偏高的是a、d
a.读取标准液体积时,开始时平视读数,结束时仰视读数
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线
c.盛装待测液的滴定管注液前未用待测溶液润洗
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失
(6)已知常温下Ka(HClO2)=1×10-2、Ka(CH3COOH)=1.75×10-5,则0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合所得溶液中各离子浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(H+)>c(OH-).
 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知 NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出固体是无水NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用下图所示装置制备亚氯酸钠.完成下列填空:
(1)组装好仪器后,检查装置气密性的操作是关闭分液漏斗的玻璃旋塞,将干燥管的末端浸末在水中,微热锥形瓶,干燥管末端有气泡产生,停止加热一段时间后,有回流的液柱,则气密性良好.
(2)装置①中用NaClO3、Na2SO3和浓H2SO4反应制得ClO2,写出该反应的化学方程式2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O,装置③发生反应的离子方程式为2ClO2+H2O2+2Na++2OH-+4H2O=2NaClO2•3H2O+O2↑.
(3)装置③反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:
①50℃左右蒸发结晶;
②趁热过滤;
③用50℃左右的温水洗涤;
④低于60℃干燥,得到成品.
步骤③中用50℃左右的温水洗涤的原因是防止产生NaClO2•3H2O晶体.
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
②取25.00mL待测液,用2.0mol•L-1Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入最后一滴Na2S2O3时,溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
(5)在实验过程中,下列操作会使实验结果偏高的是a、d
a.读取标准液体积时,开始时平视读数,结束时仰视读数
b.配制250mL待测液时,定容后摇匀发现液面下降,又补加水重新达到刻度线
c.盛装待测液的滴定管注液前未用待测溶液润洗
d.盛装标准液的滴定管尖嘴处滴定前有气泡,滴定终点时气泡消失
(6)已知常温下Ka(HClO2)=1×10-2、Ka(CH3COOH)=1.75×10-5,则0.1mol/L的HClO2溶液与0.05mol/L的NaOH溶液等体积混合所得溶液中各离子浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(H+)>c(OH-).
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 28 g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
12.下列各组化学方程式中,Q1<Q2的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-Q1kJ/mol CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H=-Q2kJ/mol | |
| B. | S(s)+O2(g)═SO2(g)△H=-Q1kJ/mol S(g)+O2(g)═SO2(g)△H=-Q2kJ/mol | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol | |
| D. | HCl(aq)+NaOH(aq)═+NaCl(aq)+H2O(I)△H=-Q1kJ/mol CH3COOH(aq)+NaOH(aq)═CH3COOHNa(aq)+H2O(l)△H=-Q2kJ/mol |
9.下列离子方程式书写正确的是( )
| A. | 向漂白粉溶液中通入少量SO2:Ca2++2ClO-+2H2O+SO2═CaSO3↓+2HClO | |
| B. | 实验室用石灰石制备CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 向NH4HCO3溶液中加入足量稀NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | 向NaOH溶液中通入少量Cl2:Cl2+2OH-═ClO-+Cl-+H2O |
 ⑥
⑥ ⑤
⑤