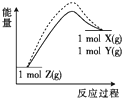
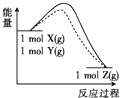
题目内容
4.在MgCl2和AlCl3的混合溶液中,Cl-的物质的量为0.7mol,Al3+与Mg2+的物质的量之比为1:2.向该溶液中逐渐加入100mL 8mol•L-1 NaOH溶液,使之充分反应.下列叙述不正确是( )| A. | 溶液中MgCl2的物质的量为0.1 mol | |
| B. | 当加入87.5 mL NaOH溶液时,沉淀质量最大 | |
| C. | 当加入90.0 mL NaOH溶液时,溶液中NaAlO2与NaCl的物质的量之比为2:35 | |
| D. | 当100 mL NaOH溶液刚好完全消耗时,Al3+恰好全部转化为Al${O}_{2}^{-}$ |
分析 A.根据电荷守恒有:3n(Al3+)+2n(Mg2+)=n(Cl-)=0.7mol,则n(Mg2+)=2n(Al3+),联立可得n(Mg2+)=0.2mol,n(Al3+)=0.1mol;
B.加入NaOH溶液得到沉淀质量最大,此时溶液中溶质为NaCl,根据钠离子守恒n(NaOH)=n(NaCl)=0.7mol,故需要NaOH溶液体积为$\frac{0.7mol}{8mol/L}$=0.875L=87.5mL;
C.氢氧化铝完全溶解时,此时溶液中溶质为NaAlO2、NaCl,消耗NaOH物质的量=n(NaAlO2)+n(NaCl)=0.1mol+0.7mol=0.8mol,需要NaOH溶液体积为$\frac{0.8mol}{8mol/L}$=0.1L=100mL,结合B中分析可知,当加入90.0 mL NaOH溶液时,生成的Al(OH)3部分溶解,溶液中n(NaCl)=n(Cl-),根据钠离子守恒计算n(NaAlO2);
D.结合C的分析进行判断.
解答 解:A.根据电荷守恒有:3n(Al3+)+2n(Mg2+)=n(Cl-)=0.7mol,则n(Mg2+)=2n(Al3+),联立可得n(Mg2+)=0.2mol,n(Al3+)=0.1mol,故MgCl2的物质的量为0.2 mol,故A错误;
B.加入NaOH溶液得到沉淀质量最大,此时溶液中溶质为NaCl,根据钠离子守恒n(NaOH)=n(NaCl)=0.7mol,故需要NaOH溶液体积为$\frac{0.7mol}{8mol/L}$=0.875L=87.5mL,故B正确;
C.氢氧化铝完全溶解时,此时溶液中溶质为NaAlO2、NaCl,消耗NaOH物质的量=n(NaAlO2)+n(NaCl)=0.1mol+0.7mol=0.8mol,需要NaOH溶液体积为$\frac{0.8mol}{8mol/L}$=0.1L=100mL,结合B中分析可知,当加入90.0 mL NaOH溶液时,生成的Al(OH)3部分溶解,溶液中n(NaCl)=n(Cl-)=0.7mol,根据钠离子守恒n(NaAlO2)=0.09L×8mol/L-0.7mol=0.02mol,故溶液中n(NaAlO2):n(NaCl)=0.02 mol:0.7 mol=1:35,故C错误;
D.根据合C的分析可知,当100 mL NaOH溶液刚好完全消耗时,Al3+恰好全部转化为AlO2-,故D正确,
故选:AC.
点评 本题考查混合物有关计算,注意根据守恒法进行计算解答,侧重考查学生分析计算能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NaCl固体溶于水 | B. | Br2与H2生成HBr | C. | SO2气体溶于水 | D. | 干冰升华 |
| A. | 通过化学变化一定能改变物质的性质 | |
| B. | 人们所使用的材料,都是纯度越高越好 | |
| C. | 氧化还原反应中一定会发生电子转移 | |
| D. | 某元素由化合态变为游离态,该元素有可能被氧化,也有可能被还原 |
 ,可用作抗凝血药.下列关于双香豆素的推论中错误的是( )
,可用作抗凝血药.下列关于双香豆素的推论中错误的是( )| A. | 分子式为C19H14O6,能与NaOH溶液反应 | |
| B. | 食草动物食用腐败草料后,在受外伤时血液不容易凝固 | |
| C. | 分子中所有碳原子不可能在同一平面 | |
| D. | 可发生水解、加成、氧化、还原反应 |
| A. | 常温常压下,20 g 氖气所含有的分子数目为0.5NA | |
| B. | 常温下,46 g 乙醇含C-H键数目为6NA | |
| C. | 1.5 mol NO2与足量H2O反应,转移的电子数为NA | |
| D. | 将0.1 mol 乙酸乙酯滴加到稀硫酸中水解,生成0.1NA个CH3COOH分子 |
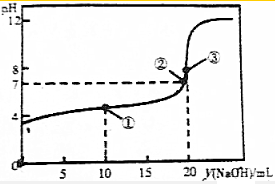 常温下,在20mL0.1mol•L-1 H2R溶液中滴加0.1mol•L-1 NaOH溶液,混合溶液的pH与滴加氢氧化钠溶液体积(V)的关系如图所示.下列说法不正确的是( )
常温下,在20mL0.1mol•L-1 H2R溶液中滴加0.1mol•L-1 NaOH溶液,混合溶液的pH与滴加氢氧化钠溶液体积(V)的关系如图所示.下列说法不正确的是( )| A. | HR-的电离程度大于水解程度 | |
| B. | ②点对应溶液中离子浓度的关系c(Na+)<c(H2R)+c(HR-)+c(R2-) | |
| C. | 在①、②、③点对应的溶液中,水电离的c(H+)•c(OH-)最大的是③ | |
| D. | 滴定前,溶液中存在粒子浓度大小关系:c(H2R)>c(H+)>c(HR-)>c(R2-)>c(OH-) |
| A. | Ag+、NO3-、Cl-、K+ | B. | Cu2+、NH4+、Br-、OH- | ||
| C. | Ag+、Ba2+、OH-、SO42- | D. | Fe2+、Na+、NO3-、SO42- |