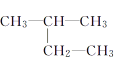题目内容
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银、铜和铅,工艺流程如图所示。

(1)步骤①当盐酸的浓度和KClO3的量一定时,写出两点可提高“浸取”速率的措施______;从Cu和Pb混合物中提取Cu的试剂为______(填名称)。
(2)步骤③反应的化学方程式为______。
(3)步骤④分离出的滤渣中主要含有两种杂质,为了回收滤渣中的非金属单质,某实验小组向滤渣中加入试剂______(填化学式),充分溶解后过滤,然后将滤液进行______(填操作名称),得到该固体非金属单质。
(4)步骤⑤反应中氧化剂和还原剂的物质的量之比为______。
(5)排放后的废水中含有NO3-,任意排放会造成水体污染,科技人员在碱性条件下用Al粉将NO3-还原成无污染气体排放,该方法的缺点是处理后的水中生成了AlO2-,依然对人类健康有害。该反应的离子方程式为:______。25℃时,欲将上述处理过的水中的c(AlO2-)降到1.0×10-7mol/L,此时水中c(Al3+)=______molL-1.(已知,25℃,Ksp(Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13)
【答案】粉碎银精矿或适当增大液固比或适当提取浸取温度或适当延长浸取时间或充分搅拌 稀盐酸 AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl CS2 蒸馏 4:1 10Al+6 NO3-+4OH-=2N2+10AlO2-+2H2O 1.3×10-9
【解析】
银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)加盐酸和氯酸钾浸取,过滤,溶液中含有Zn2+、Cu2+、Pb2+,滤渣中含有S、SiO2、AgCl等;浸出液中加金属还原剂Zn,把Cu2+、Pb2+还原为单质,则试剂X为Zn,分离操作②为过滤,得到Cu和Pb、ZnCl2溶液;浸出渣含有S、SiO2、AgCl,加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag(SO3)2]和NaCl,过滤,滤渣为S和SiO2,滤液为Na3[Ag(SO3)2]和NaCl,在滤液中加N2H4和NaOH,生成Ag和氮气;滤液中含有亚硫酸钠,氧化生成硫酸钠。
(1)为提高浸取率可采取的措施:进一步粉碎银精矿或适当增大液固比或适当提高浸取温度或适当延长浸取时间或充分搅拌等,Cu和Pb混合物中提取Cu可选用稀盐酸,根据金属活动性顺序表可知,Pb可与稀盐酸反应,Cu不反应,再过滤即可,故答案为:粉碎银精矿或适当增大液固比或适当提取浸取温度或适当延长浸取时间或充分搅拌;稀盐酸;
(2)步骤③加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag(SO3)2]和NaCl,化学方程式为AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl,故答案为:AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl;
(3)步骤④分离出的滤渣中主要含有S和SiO2两种杂质,利用S易溶于CS2,滤渣中加入CS2,充分溶解后过滤,然后根据S和CS2的沸点不同进行蒸馏即可,故答案为:CS2;蒸馏;
(4)步骤⑤的化学反应方程式为:4Na3[Ag(SO3)2]+N2H4+4NaOH=4Ag↓+8Na2SO3+N2↑+4H2O,Na3[Ag(SO3)2]作氧化剂,N2H4作还原剂,其氧化剂和还原剂的物质的量之比为4:1,故答案为4:1;
(5)在碱性条件下用Al粉将NO3-还原成无污染的N2排放,其离子方程式为:10Al+6 NO3-+4OH-=2N2+10AlO2-+2H2O,已知,25℃,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13,可得,Ka= c(H+)·c(AlO2-)= c(H+)·1.0×10-7mol/L=1.0×10-13,
c(H+)=1.0×10-6mol/L,c(OH-)=1.0×10-8mol/L, Ksp[Al(OH)3]= c(Al3+)·c3(OH-)=1.3×10-33,c(Al3+)=1.3×10-9molL-1,故答案为10Al+6 NO3-+4OH-=2N2+10AlO2-+2H2O;1.3×10-9。

 阅读快车系列答案
阅读快车系列答案【题目】在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是( )
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+ H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
A.已知t2>t1,HX的生成反应为放热反应
B.在相同条件下, X2平衡转化率:F2>Cl2
C.X2的活泼性随原子序数递增逐渐减弱
D.2F2+2H2![]() 4HF K(t1)=3.6×1036
4HF K(t1)=3.6×1036
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:________________。
(2)今有如下两个热化学方程式:则a_________b(填“>”、“=”或“<”)
2H2(g)+O2(g)=2H2O(g)△H1=a kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H2=b kJmol﹣1
(3)已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJmol﹣1.试根据表中所列键能数据估算a 的值:________________________(注明“+”或“﹣”)。
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=﹣90.8kJmol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41.3kJmol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=_________.
(5)已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1。
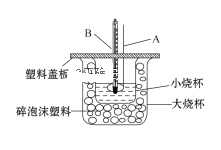
①仪器A的名称___________________;碎泡沫塑料的作用是___________________。
②仪器A不能用铜质搅拌棒代替,其原因是________________________。
③若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯。甲烷在催化作用下脱氢,在不同温度下分别形成CH3、![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
物质 | 燃烧热(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式______。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)。该反应符合最理想的原子经济,则反应产物是______(填结构简式)。
(3)在一定条件下,向2L的恒容密闭反应器中充入1molCH4,发生上述(1)反应,10分钟后达到平衡,测得平衡混合气体中C2H4的体积分数为20.0%.则:
①用CH4表示该反应的平均速率为______。
②在该温度下,其平衡常数K=______。
③下列说法正确的是______。
a.升高温度有利于提高C2H4的产率
b.向平衡体系中充入少量He,CH4的转化率降低
c.当混合气体的密度不再变化时,说明该反应达到平衡状态
d.向上述平衡体系中再充入1molCH4,达到平衡后H2的体积分数减小
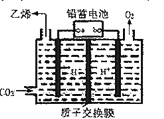
e.若实验测得:v(正)=k(正)c2(CH4),v(逆)=k(逆)c2(H2)c(C2H4)。其中k(正)、k(逆)为受温度影响的速率常数,该反应的平衡常数K=![]()
(4)以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。电解过程中,阳极区溶液中c(H+)逐渐______(填“增大”、“减小”或“不变”),阴极反应式______。