题目内容
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:________________。
(2)今有如下两个热化学方程式:则a_________b(填“>”、“=”或“<”)
2H2(g)+O2(g)=2H2O(g)△H1=a kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H2=b kJmol﹣1
(3)已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJmol﹣1.试根据表中所列键能数据估算a 的值:________________________(注明“+”或“﹣”)。
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=﹣90.8kJmol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41.3kJmol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=_________.
(5)已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1。
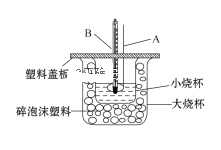
①仪器A的名称___________________;碎泡沫塑料的作用是___________________。
②仪器A不能用铜质搅拌棒代替,其原因是________________________。
③若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
【答案】CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.4KJ/mol > -93 -246.4 kJmol-1 环形玻璃搅拌棒 保温隔离隔热作用 铜棒易导致热量的散失 a、c、d
O2(g)═CO2(g)+2H2O(l)△H=﹣726.4KJ/mol > -93 -246.4 kJmol-1 环形玻璃搅拌棒 保温隔离隔热作用 铜棒易导致热量的散失 a、c、d
【解析】
(1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比燃烧热指1mol(32g)CH3OH燃烧放出的热量;
(2)两个热化学方程式的区别在于物质的聚集状态不同,固体→液体→气体的过程为吸热过程,反之为放热过程,以此解答该题;
(3)根据反应热等于反应物的总键能-生成物的总键能分析解答;
(4)依据热化学方程式和盖斯定律计算得到;
(5)①仪器A的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作;
②金属导热性好;
(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,32g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出![]() ×113.5KJ=726.4kJ热量,
×113.5KJ=726.4kJ热量,
则热化学方程式为:CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.4KJ/mol,故答案为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H=﹣726.4KJ/mol,故答案为:CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.4KJ/mol;
O2(g)═CO2(g)+2H2O(l)△H=﹣726.4KJ/mol;
(2)a与b相比较,由于气体变成液体放热,则b反应放出的热量比a多,由于a,b都是负值,则a>b,
故答案为:>;
(3)N2+3H22NH3中的△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1,
故答案为:-93;
(4)①2H2(g)+CO(g)CH3OH(g)△H=-90.8kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H=-23.5kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.3kJmol-1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的△H=-246.4 kJmol-1,
故答案为:-246.4 kJmol-1;
(5)①为保证液体充分混合并反应,需要使用玻璃搅拌棒,反应热测定实验中保温工作是关键,碎泡沫塑料的作用是隔热,减少反应制的热量损失,
故答案为:环形玻璃搅拌棒;隔热,防止热量损失;
②在测定中和热时,必须做好保温工作,环形铜质搅拌棒会导致较多的热量散失,影响测定结果,
故答案为:铜棒易导致热量的散失;
a.实验装置保温、隔热效果差,导致测定的最高温度偏小,测定的温度差偏小,测定结果偏低,故a错误;
b.量取NaOH溶液的体积时仰视读数,导致量取的氢氧化钠溶液的体积偏大,若盐酸过量,反应生成的水的物质的量偏大,放出的热量偏高,测定的最高温度偏大,测定结果偏高;若盐酸不足,则不影响测定结果,故b错误;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,导致有部分热量散失,测定的最高温度偏小,温度差偏小,测定结果偏低,故c正确;
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度,导致温度计上的部分盐酸与氢氧化钠溶液反应,测定的氢氧化钠溶液的初始温度偏高,计算出的温度差偏低,测定结果偏低,故d正确;
故答案为:acd;