题目内容
CO(g)+H2O(g)  H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
| A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
B
解析试题分析:A.加入催化剂,改变了反应的途径,但不改变反应物和产物的能量,故反应放出的热量不改变,故原说法错误;B.改变压强,平衡不发生移动,反应放出的热量不变,正确;C.升高温度,反应速率加快,使上述平衡向吸热方向移动,即逆向移动,反应放出的热量减小,原说法错误;D.若在原电池中进行,将化学能转化为电能了,反应放出的热量大大减少,个原说法不正确。
考点:可逆反应放出的热量的认识。

练习册系列答案
相关题目
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:
若在反应中消耗了1 mol乙烷(反应物),则有关该反应的说法正确的是( )
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知: 1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.+1220 kJ/mol | C.-1220 kJ/mol | D.+1780 kJ/mol |
在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 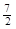 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1 |
| B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g)△H =-1560kJ·mol-1 |
| C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l)△H =+3120 kJ·mol-1 |
D.C2H6(g) +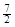 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1 |
下列反应属于吸热反应的是( )
| A.石灰石在高温下的分解反应 | B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.木炭在氧气中燃烧 |
参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是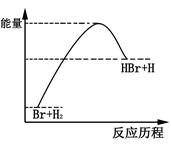
| A.正反应为吸热反应 |
| B.该反应的逆反应是吸热过程 |
| C.HBr的能量一定高于H2的能量 |
| D.反应物具有的总能量大于生成物具有的总能量 |
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |