题目内容
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)写出该反应的化学平衡常数表达式K=
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
(2)降低温度,该反应K值
增大
增大
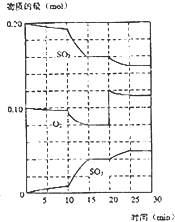
(填“增大、减小或不变”)(3)在600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是
15-20min
15-20min
和25-30min.(4)在第一次平衡状态时,SO2的转化率是
20%
20%
.(5)在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L.通过计算,判断此混合体系中反应进行的方向.要求写出具体的计算过程.
分析:(1)平衡常数等于平衡状态下生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
(2)依据化学反应是放热反应,降温向放热反应方向进行;
(3)平衡状态是一定条件下物质浓度不再改变,物质的量不变,正逆反应速率相同;
(4)依据图象分析二氧化硫物质的量从0.2mol变化为0.16mol,结合转化率概念计算;
(5)平衡常数随温度变化,通过图象数据计算平衡常数,依据反应过程的浓度商和平衡常数比较分析判断.
(2)依据化学反应是放热反应,降温向放热反应方向进行;
(3)平衡状态是一定条件下物质浓度不再改变,物质的量不变,正逆反应速率相同;
(4)依据图象分析二氧化硫物质的量从0.2mol变化为0.16mol,结合转化率概念计算;
(5)平衡常数随温度变化,通过图象数据计算平衡常数,依据反应过程的浓度商和平衡常数比较分析判断.
解答:解:(1)2SO2(g)+O2(g)?2SO3(g)△H<0
依据化学方程式分析,达到平衡状态时的平衡常数,用平衡浓度计算得到:K=
,故答案为:
;
(2)2SO2(g)+O2(g)?2SO3(g)△H<0;分析反应可知,是放热反应,降温,平衡向放热反应方向移动,所以平衡常数增大,故答案为:增大;
(3)平衡状态是一定条件下物质浓度不再改变,物质的量不变,正逆反应速率相同;依据图象分析在15-20min;25-30min时平衡状态,故答案为:15-20min;
(4)图象分析二氧化硫第一次平衡,物质的量从0.2mol变化为0.16mol,转化率=
×100%=20%,故答案为:20%;
(5)图象分析,600°C,第一次平衡状态下,n(SO2)=0.16mol;n(O2)=0.08mol;n(SO3)=0.04mol;
25-30min,达到新的平衡是改变压强浓度形成,平衡常数随温度变化,设体系体积为1L;平衡时物质的浓度为:c(SO2)=0.16mol/L;c(O2)=0.08mol/L;c(SO3)=0.04mol/L;
则化学平衡常数K=
=0.78L/mol;
在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L;
浓度商为:Qc=
=8>K,所以反应向逆向进行,
答:逆向进行.
依据化学方程式分析,达到平衡状态时的平衡常数,用平衡浓度计算得到:K=
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
(2)2SO2(g)+O2(g)?2SO3(g)△H<0;分析反应可知,是放热反应,降温,平衡向放热反应方向移动,所以平衡常数增大,故答案为:增大;
(3)平衡状态是一定条件下物质浓度不再改变,物质的量不变,正逆反应速率相同;依据图象分析在15-20min;25-30min时平衡状态,故答案为:15-20min;
(4)图象分析二氧化硫第一次平衡,物质的量从0.2mol变化为0.16mol,转化率=
| 0.2mol-0.16mol |
| 0.2mol |
(5)图象分析,600°C,第一次平衡状态下,n(SO2)=0.16mol;n(O2)=0.08mol;n(SO3)=0.04mol;
25-30min,达到新的平衡是改变压强浓度形成,平衡常数随温度变化,设体系体积为1L;平衡时物质的浓度为:c(SO2)=0.16mol/L;c(O2)=0.08mol/L;c(SO3)=0.04mol/L;
则化学平衡常数K=
| (0.04mol/L)2 |
| (0.16mol/L)2×0.08mol/L |
在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L;
浓度商为:Qc=
| (0.2mol/L)2 |
| (0.1mol/L)2×0.5mol/L |
答:逆向进行.
点评:本题考查了化学平衡的特征,平衡常数的概念、计算应用,图象分析和数据应用能力,主要是反应进行方向的判断方法,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示,下列相关说法正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示,下列相关说法正确的是( )| A、苹果酸在一定条件下能发生消去反应 | B、苹果酸在一定条件下能催化氧化生成醛 | C、苹果酸在一定条件下能发生加聚反应生成高分子化合物 | D、1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3 |




