题目内容
乙酸乙酯是重要的化工原料,生产乙酸乙酯的途径也很多.已知乙醛(CH3CHO)在一定条件下可被氧化成乙酸,也可以被还原成乙醇.现有淀粉、水、空气、乙烯等原料,如果分别用上述两种不同的有机原料开始合成乙酸乙酯,请绘制出有关的合成路线图,并在图中标明原料和各步转化产物(有机产物)的名称(无须写反应方程式).
示例:
合成路线一:

合成路线二:
 .
.
示例:

合成路线一:


合成路线二:


分析:可分别易淀粉和乙烯为原料制备,以淀粉为原料,经水解生成葡萄糖,葡萄糖生成乙醇,乙醇被氧化生成乙醛、乙酸,二者酯化可生成乙酸乙酯;
如以乙烯为原料,乙烯和水发生加成反应生成乙醇,乙醇乙醇被氧化生成乙醛、乙酸,二者酯化可生成乙酸乙酯.
如以乙烯为原料,乙烯和水发生加成反应生成乙醇,乙醇乙醇被氧化生成乙醛、乙酸,二者酯化可生成乙酸乙酯.
解答:解:合成路线一:以淀粉为原料,经水解生成葡萄糖,葡萄糖生成乙醇,乙醇被氧化生成乙醛、乙酸,二者酯化可生成乙酸乙酯,可为 ,
,
故答案为: ;
;
合成路线二:以乙烯为原料,乙烯和水发生加成反应生成乙醇,乙醇乙醇被氧化生成乙醛、乙酸,二者酯化可生成乙酸乙酯,可为 ,
,
故答案为: .
.
 ,
,故答案为:
 ;
;合成路线二:以乙烯为原料,乙烯和水发生加成反应生成乙醇,乙醇乙醇被氧化生成乙醛、乙酸,二者酯化可生成乙酸乙酯,可为
 ,
,故答案为:
 .
.点评:本题考查有机物的合成,题目难度不大,解答本题的关键是根据淀粉和乙烯的性质首先制备出乙醇.

练习册系列答案
相关题目
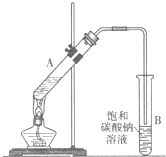 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| ℃140 |
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为
(2)试管B中导管接近液面未伸入液面下的理由是
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:
乙酸乙酯是重要的化工原料,沸点约77℃.其水解反应方程式为:CH3COOC2H5+H2O?CH3COOH+C2H5OH,酸和碱均可用作该反应的催化剂.某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究.
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.数据记录:
乙酸乙酯水解后剩余的高度/min
回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有 、 、 .
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
① .
②乙酸乙酯水解速率先快后慢,一段时间后达到平衡状态.
(3)结论②的理论解释是 .
(4)欲使乙酸乙酯完全水解,可采取的措施是 .
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是 .
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.数据记录:
乙酸乙酯水解后剩余的高度/min
| 组别 | c(NaOH)/mol?L-1 | 时间/min | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| 1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 |
| 2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 |
| 3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①
②乙酸乙酯水解速率先快后慢,一段时间后达到平衡状态.
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是


 C2H5OC2H5+H2O
C2H5OC2H5+H2O