题目内容
3.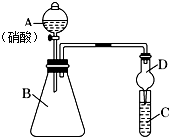 学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.
学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.(1)写出选用物质的化学式:BNa2CO3、CNa2SiO3.干燥管D的作用是防倒吸
(2)该装置存在缺陷,请指出:硝酸具有挥发性,与生成的CO2一起进入装置C中,则无法证明C、Si的非金属性强弱,改进的方法是:在B,C间连接一个装有饱和NaHCO3溶液 的洗气瓶
(3)改进后,进行实验.根据实验目的,烧杯C中发生反应的离子方程式H2O+CO2+SiO32-═H2SiO3↓+CO32-,
(4)通过实验得出的结论:元素非金属性强弱顺序为N>C>Si;从原子结构的角度简要分析同周期元素性质递变的原因:同周期元素核外电子层数相同,随原子序数增大,核电荷数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
分析 (1)装置中为强酸制备弱酸依此选择试剂,C中为二氧化碳与硅酸钠溶液的反应,装置图中D的上端体积较大,可以防倒吸;
(2)分析装置图可知,硝酸具有挥发性,挥发出的硝酸会素二氧化碳进入装置C,和硅酸钠溶液反应生成沉淀分析,改进方法需要除去硝酸但不能引入杂质;
(3)通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,碳酸酸性大于硅酸;
(4)通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸依此选择试剂,根据同周期和同主族元素非金属性的变化规律分析,最高价含氧酸酸性强弱即为非金属性强弱;
解答 解:(1)通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,试管C中为二氧化碳与硅酸钠溶液的反应,其离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-,由装置图可知,装置图中D的上端体积较大,可以防倒吸;
故答案为:Na2CO3,Na2SiO3,防倒吸;
(2)硝酸具有挥发性,挥发出的硝酸会素二氧化碳进入装置C,和硅酸钠溶液反应,也会生成白色沉淀干扰判断,无法证明C、Si的非金属性强弱,改进措施是在B,C间连接一个装有饱和NaHCO3溶液的洗气瓶吸收硝酸,
故答案为:硝酸具有挥发性,与生成的CO2一起进入装置C中,则无法证明C、Si的非金属性强弱,在B,C间连接一个装有饱和NaHCO3溶液的洗气瓶;
(3)试管C中为二氧化碳与硅酸钠溶液的反应,其离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-,
故答案为:H2O+CO2+SiO32-═H2SiO3↓+CO32-;
(4)装置中为强酸制备弱酸,A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,通过实验得出的结论:元素非金属性强弱顺序为:N>C>Si,同周期元素核外电子层数相同,随原子序数增大,核电荷数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强,
故答案为:N>C>Si,同周期元素核外电子层数相同,随原子序数增大,核电荷数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
点评 本题考查了元素非金属性强弱的比较,侧重于考查学生的实验探究能力,题目难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{3}{2}$ | B. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{1}{2}$ | C. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<4 | D. | $\frac{1}{2}$<$\frac{n(X)}{n(Y)}$<4 |
| A. | NaHSO3溶液中水的电离程度小于Na2SO3 溶液,也小于Na2SO4 溶液 | |
| B. | [HSO3-]>[SO32-]>[H2SO3 ] | |
| C. | 该溶液中由水电离出的[H+]为1×10-4mol/L | |
| D. | 加入少量NaOH使溶液的pH升高会使水的电离受到抑制 |
| A. | 化学键是一种静电引力 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 只要有旧健的断裂就一定是化学反应 | |
| D. | 氢键是一种化学键 |

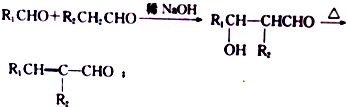
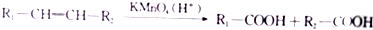
 .
. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式).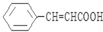 )的合成路线示意图.
)的合成路线示意图.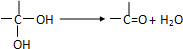
 某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.
某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.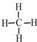 .乙烯的电子式是
.乙烯的电子式是 .将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5
.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5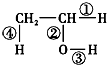 在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.
在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.