题目内容
2.在某密闭容器中进行如下反应:X(g)+2Y(g)?2Z(g),若开始时,只加入X、Y两种物质,达到平衡后,测得混合气体中反应物总物质的量与生成物的总物质的量相等,则X、Y的初始物质的量之比的范围应满足( )| A. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{3}{2}$ | B. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{1}{2}$ | C. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<4 | D. | $\frac{1}{2}$<$\frac{n(X)}{n(Y)}$<4 |
分析 设参加反应的X的物质的量为n,利用三段式法求出平衡时各组分的物质的量,根据平衡时反应物总物质的量与生成物总物质的量相等,用x、y表示出n,再利用可逆反应的不完全性,反应物不能完全反应列不等式讨论.
解答 解:设参加反应的X的物质的量为n,
X(g)+2Y(g)?2Z(g),
开始(mol):x y 0
转化(mol):n 2n 2n
平衡(mol):x-n y-2n 2n
平衡时反应物总物质的量与生成物总物质的量相等,则:x-n+y-2n=2n,
解得:n=$\frac{x+y}{5}$,
可逆反应中反应物不能完全反应,则y>2n,即:y>$\frac{2(x+y)}{5}$,整理可得:$\frac{x}{y}$<$\frac{3}{2}$,
x>n,则x>$\frac{x+y}{5}$,解得:$\frac{x}{y}$>$\frac{1}{4}$,
所以X、Y的初始物质的量之比的范围为$\frac{1}{4}$<$\frac{n(X)}{n(Y)}$=$\frac{x}{y}$<$\frac{3}{2}$,
故选A.
点评 本题考查化学平衡计算,题目难度中等,关键在于利用反应物不能完全反应列不等式,注意掌握讨论法在化学计算中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
12.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素 代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半 径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | G元素的单质不存在同素异形体 | |
| B. | I在DB2中燃烧生成两种化合物 | |
| C. | A的单质能将E单质从HE3的溶液中置换出来 | |
| D. | A、H、J的离子半径由大到小顺序是A>J>H |
10.下列有关实验数据处理,正确的是( )
| A. | 用pH试纸测得新制氯水的pH为2 | |
| B. | 中和滴定实验中,滴定管内液面对应的刻度由0 mL变为10 mL | |
| C. | 某同学在托盘天平左盘放置5g砝码,游码位于0.5g处,则所得药品质量为5.5g | |
| D. | 质量分数为20%的NaCl溶液与水等质量混合,稀释后溶液的质量分数必为10% |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 14g 乙烯和丁烯的混合物中含有3NA对共用电子对 | |
| B. | 1mol苯中含有3NA个碳碳双键 | |
| C. | 乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L | |
| D. | 标准状况下,22.4L己烷中的碳原子数为6NA |
7.在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,关于该反应下列说法中不正确的是( )
| A. | H2O既不是氧化产物也不是还原产物 | |
| B. | 该反应中被氧化和被还原的氮元素的质量比是3:2 | |
| C. | 若有2mol NH3完全反应,共转移12mol电子 | |
| D. | NO是氧化剂,NH3是还原剂 |
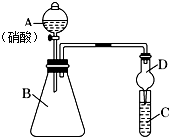 学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.
学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.