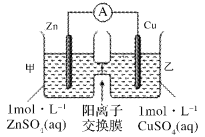
题目内容
【题目】将二氧化碳转化为乙烯的装置如图,使用的电极材料均为惰性电极。下列正确的是( )
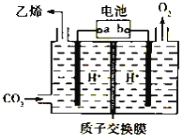
A. a为电源的正极B. 每生成0.1mol乙烯,同时生成6.72LO2
C. 电解过程中,阳极区c(H+)逐渐减小D. 阴极反应为:2CO2+12H++12e- = C2H4+4H2O
【答案】D
【解析】
电解强酸性的二氧化碳水溶液得到乙烯,二氧化碳得电子生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,为还原反应,a为电池的负极,则b为电池的正极,阳极上氢氧根失电子放出氧气,据此分析解答。
A.由二氧化碳得电子生成乙烯,发生还原反应,所以a为电池的负极,故A错误;
B.阴极二氧化碳得电子生成乙烯,阳极氢氧根失电子放出氧气,总反应为:2CO2+2H2O=C2H4+3O2,每生成0.1mol乙烯,同时生成0.3molO2,但温度压强不知,不能计算生成氧气的体积,故B错误;
C.阳极氢氧根失电子放出氧气,阳极区c(H+)增大,故C错误;
D.由二氧化碳得电子生成乙烯,发生还原反应,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故D正确;
故选D。

【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。