题目内容
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
【答案】-747 bc 0.08mol![]() L-1
L-1![]() min-1 0.86 > 2.0×10-4 5.0×10-5
min-1 0.86 > 2.0×10-4 5.0×10-5
【解析】
(1)根据盖斯定律计算反应热;根据2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的正反应为气体体积减小的放热反应分析改变的条件;
N2(g)+2CO2(g)的正反应为气体体积减小的放热反应分析改变的条件;
(2) ①由表可知10min后浓度不再改变,处于平衡状态,用三段式分析浓度改变,根据![]() =
=![]() 计算速率;根据K=
计算速率;根据K=![]() 计算平衡常数。
计算平衡常数。
②第15min后,温度调整到T2,由表中数据可知NO减少,N2增加,平衡正向移动,由于正反应为放热反应,改变条件为降温。
(3)依据Ksp(AgCl)=2.0×10-10,计算c(Ag+)= Ksp(AgCl)/c(Cl-),依据Ksp(Ag2CrO4)= 2.0×10-12计算c(CrO42-)= Ksp(Ag2CrO4)/c2(Ag+)。
(1)已知:①2C(s)+O2(g)=2CO(g) △H=-22lkJ/mol,
②C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol,
③N2(g)+O2(g)=2NO(g) △H=+181 kJ/mol,
根据盖斯定律:②×2-①-③得:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-747 kJ/mol;
N2(g)+2CO2(g) △H=-747 kJ/mol;
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的正反应为气体体积减小的放热反应,
N2(g)+2CO2(g)的正反应为气体体积减小的放热反应,
a.增大容器的体积,压强减小,平衡逆向移动,NO的转化率减小,故不选a;
b.降低温度平衡正向移动,NO的转化率增大,故选b;
c.增大CO的浓度,平衡正向移动,NO的转化率增大,故选c;
d.增大NO的浓度,NO的转化率减小,故不选d。
因此,本题正确答案是:-747;bc;
(2) ①由表可知10min后浓度不再改变,处于平衡状态,用三段式分析浓度改变
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始(mol) 2.0 0 0
变化(mol) 1.3 0.65 0.65
平衡(mol) 0.70 0.65 0.65
则NO、N2和CO2在10min时平衡浓度分别为:0.35mol/L、0.325mol/L和0.325mol/L,
0~5min内,以NO表示的该反应速率υ(NO)=![]() =0.08mol
=0.08mol![]() L-1
L-1![]() min-1,
min-1,
平衡常数K=![]() =
=![]() =0.86。
=0.86。
②第15min后,温度调整到T2,由表中数据可知NO减少,N2增加,平衡正向移动,由于正反应为放热反应,改变条件为降温,则T1>T2。
因此,本题正确答案是:0.08mol![]() L-1
L-1![]() min-1;0.86;>;
min-1;0.86;>;
(3)当溶液中Cl-恰好沉淀完全时,即c(Cl-)=1.0×10-6mol·L-1,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)= Ksp(AgCl)/c(Cl-)=![]() mol·L-1=2.0×10-4mol/L,
mol·L-1=2.0×10-4mol/L,
此时溶液中c(CrO42-)= Ksp(Ag2CrO4)/c2(Ag+)=![]() mol·L-1= 5.0×10-5 mol·L-1。
mol·L-1= 5.0×10-5 mol·L-1。
因此,本题正确答案是:2.0×10-4;5.0×10-5。

【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
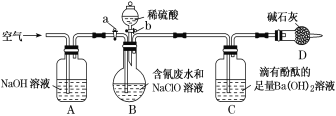
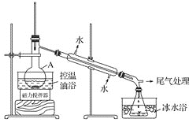
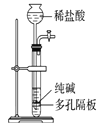
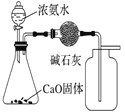
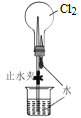
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
选项 | A | B | C | D |
实验 装置 |
|
|
|
|
实验 目的 | 制取少量纯净的CO2气体 | 验证钠和水的反应是放热反应 | 制取并收集干燥纯净的NH3 | 进行喷泉实验 |
A.AB.BC.CD.D