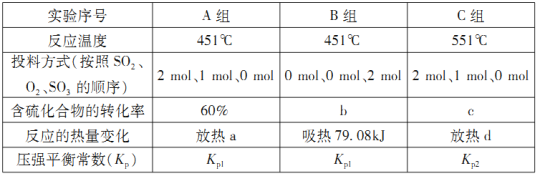
题目内容
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。
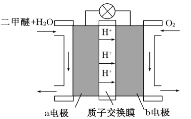
a电极是________极,其电极反应方程式为_________________。
【答案】自发 -246.1 kJ/mol ![]() > CO、H2、甲醇和水 负 CH3OCH3-12e-+3H2O=2CO2+12H+
> CO、H2、甲醇和水 负 CH3OCH3-12e-+3H2O=2CO2+12H+
【解析】
Ⅰ.(1)依据自发进行的判断依据为△H-T△S<0,是自发进行的反应;△H-T△S>0,是非自发进行的反应;
(2)依据热化学方程式和盖斯定律计算得到热化学方程式;根据化学平衡常数的含义可得其表达式;催化反应室内的反应条件是压力2.0~10.0Mpa,温度230~280℃;结合影响化学平衡的因素分析判断;
(3)依据反应过程中的中间产物是可以循环利用的物质;
Ⅱ.反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,O2在正极发生还原反应,氧气在正极放电,由图中H+的移动方向知,a极为负极,二甲醚放电生成二氧化碳与氢离子。
I.(1)甲烷氧化可制合成气:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g),△S>0,△H<0,△H-T△S<0,因此反应能自发进行;
CO(g)+2H2(g),△S>0,△H<0,△H-T△S<0,因此反应能自发进行;
(2)催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol
依据盖斯定律①×2+②+③得到:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)ΔH=-246.1kJ/mol;由于化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,则该反应的化学平衡常数表达式为K=
CH3OCH3(g)+CO2(g)ΔH=-246.1kJ/mol;由于化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,则该反应的化学平衡常数表达式为K=![]() ;
;
在830℃时反应的K=1.0,在催化反应室中,压力2.0~10.0Mpa,温度230~280℃,温度降低,平衡向正反应方向移动,因此反应的K增大;
(3)依据催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应,
①CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol
甲醇和水是中间产物,结合生产流程,CO、H2也可以部分循环,故可以循环利用的物质CO、H2、甲醇和水。
II.在该燃烧电池中,根据H+的移动方向可知,通入二甲醚的a电极为负极,二甲醚在负极失去电子,发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+。