题目内容
实验室用以下三种途径来制取相同质量的硝酸铜:
①铜与浓硝酸反应;
②铜与稀硝酸反应;
③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
从消耗原料和是否污染环境的角度,下列有关叙述不正确的是( )
①铜与浓硝酸反应;
②铜与稀硝酸反应;
③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
从消耗原料和是否污染环境的角度,下列有关叙述不正确的是( )
| A.所消耗的铜的质量相等 |
| B.所消耗的硝酸的量:①>②>③ |
| C.对环境造成的危害,③最小 |
| D.制取硝酸铜的最佳方案是① |
方案中节约原料,则反应需步骤简单,消耗原料较少,为防止污染环境,应尽量少产生或不产生污染性气体.
①铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,制备1molCu(NO3)2,需要2molHNO3,生成的2molNO2气体有毒,是污染性的气体;
②铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备1molCu(NO3)2,需要
molHNO3,生成
mol有毒的NO气体;
③铜与氧气反应生成CuO,2Cu+O2
2CuO,氧化铜和硝酸反应生成硝酸铜和水,制备1molCu(NO3)2,需要2molHNO3,且没有生成污染性气体;
A.制取相同质量的硝酸铜,制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要1molCu,②需要1molCu,③需要1molCu,所以所消耗的铜的质量相等,故A正确;
B.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要2molHNO3,②需要
molHNO3,③需要2molHNO3,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,故B正确;
C.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①生成的2molNO2污染性的气体,②生成
mol有毒的NO气体,③没有生成污染性气体,故C正确;
D.由方程式通过比较可以看出,生成相同质量的Cu(NO3)2,铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,故D错误;
故选D.
①铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,制备1molCu(NO3)2,需要2molHNO3,生成的2molNO2气体有毒,是污染性的气体;
②铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备1molCu(NO3)2,需要
| 8 |
| 3 |
| 2 |
| 3 |
③铜与氧气反应生成CuO,2Cu+O2
| ||
A.制取相同质量的硝酸铜,制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要1molCu,②需要1molCu,③需要1molCu,所以所消耗的铜的质量相等,故A正确;
B.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要2molHNO3,②需要
| 8 |
| 3 |
C.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①生成的2molNO2污染性的气体,②生成
| 2 |
| 3 |
D.由方程式通过比较可以看出,生成相同质量的Cu(NO3)2,铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,故D错误;
故选D.

练习册系列答案
相关题目

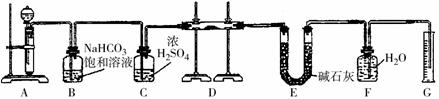

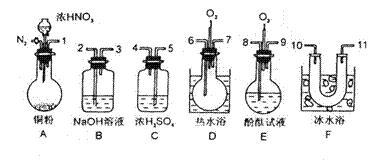
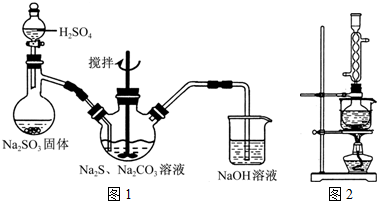
 某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验
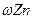 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。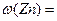 = 。
= 。