题目内容
7.(1)3.6g H2O的物质的量是0.2mol,含有0.4mol H.(2)在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是H2,质量最大的是H2O.(填化学式)
(3)等质量的二氧化硫和三氧化硫,它们的物质的量之比为5:4,所含的硫原子数之比为5:4,所含的氧原子数之比为5:6.
(4)下列物质:①H2O ②石墨 ③NH4NO3 ④硫酸 ⑤CH3COOH ⑥蔗糖 属于弱电解质的是①⑤;属于非电解质的是⑥(用编号填写).
分析 (1)根据n=$\frac{m}{M}$计算水的物质的量,氢原子物质的量为水的2倍;
(2)根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算氢气、氧气物质的量,物质的量越大含有分子数目越多;再根据m=nM计算氧气、水的质量,进而判断质量关系;
(3)根据n=$\frac{m}{M}$计算物质的量之比,结合分子式计算含有S原子、O原子数目之比;
(4)弱电解质:在水溶液中只有部分电离的电解质是弱电解质,弱酸、弱碱、水等属于弱电解质;
非电解质:在水溶液中或熔融状态下都不导电的化合物,非金属氧化物(水除外)、大多数有机物等属于非电解质.
解答 解:(1)3.6g 水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,氢原子物质的量为0.2mol×2=0.4mol,
故答案为:0.2mol;0.4;
(2)4g H2的物质的量为$\frac{4g}{2g/mol}$=2mol,11.2L O2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,其质量为0.5mol×32g/mol=16g,1mol H2O的质量为1mol×18g/mol=18g,
物质的量越大含有分子数目越多,故所含分子数最多的是H2,质量最大的是H2O,
故答案为:H2;H2O;
(3)根据n=$\frac{m}{M}$可知,等质量的二氧化硫和三氧化硫的物质的量之比为80g/mol:64g/mol=5:4,结合分子式可知,含有S原子数目之比为5:4,含有O原子数目之比为5×2:4×3=5:6,
故答案为:5:4;5:4;5:6;
(4)①H2O属于弱电解质,②石墨为单质,既不是电解质也不是非电解质,③NH4NO3属于盐,属于强电解质,④硫酸为强酸,属于强电解质,⑤CH3COOH为弱酸,属于弱电解质,⑥蔗糖属于共价化合物,在水溶液中不能电离,属于非电解质,
故属于弱电解质的是:①⑤;属于非电解质的是⑥,
故答案为:①⑤;⑥.
点评 本题考查物质的量有关计算、电解质与非电解质、强弱电解质等,比较基础,注意对基础知识的理解掌握.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | WX2分子中W原子采取sp3杂化 | |
| B. | WX2是以极性键结合成的非极性分子 | |
| C. | WX2、YX2中的化学键和晶体类型都相同 | |
| D. | 原子半径大小顺序为:X<W<Y<Z |
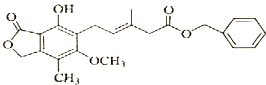
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1 mol 该化合物最多可以与3 mol NaOH反应 | |
| C. | 既能催化加氢,又能使酸性KMnO4溶液褪色 | |
| D. | 既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应放出CO2气体 |
| 选项 | A | B | C | D |
| 物质 | Na2CO3 | CH3COOH | NH3•HO2 | Na2SiO3 |
| 类别 | 碱 | 弱电解质 | 非电解质 | 强碱弱酸盐 |
| 用途或储存方法 | 氯碱工业产品之一 | 制食醋 | 棕色瓶密封保存 | 带玻璃塞的试剂瓶保存 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na+、NH4+、Cl- | B. | Mg2+、Ba2+、Cl- | C. | Mg2+、Fe2+、NO3- | D. | Al3+、CO32-、Cl- |
| A. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| B. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| C. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| D. | 容量瓶在使用之前必须进行检漏操作 |