题目内容
19.合成氨是人类科学技术发展史上一项重大突破,解决了地球上因粮食不足而导致的饥饿和死亡问题.氨可用于工业上制硝酸,其中的一步反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,其中还原剂是NH3(填化学式),若有68g NH3参加反应,转移电子的物质的量为20mol.分析 根据反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2可知,氨气中氮元素的化合价从-3价升高到+2价,失去5个电子,据此分析即可.
解答 解:根据反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2可知,氨气中氮元素的化合价从-3价升高到+2价,失去5个电子,氧气中氧元素的化合价从0价降低到-2价,得到2个电子,所以还原剂是氨气,68g氨气的物质的量是68g÷17g/mol=4mol,所以反应中转移电子的物质的量是4mol×5=20mol,
故答案为:NH3;20.
点评 本题考查了氧化还原反应概念及电子转移的计算,题目难度不大,侧重于氧化还原反应概念的考查,注意对基础知识的归纳整理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.海水开发利用的部分过程如图所示.下列说法错误的是( )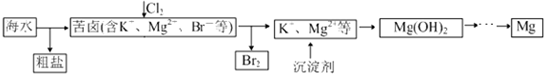

| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 向苦卤中通入Cl2 是为了提取溴 | |
| C. | 实际生产中常选用Ca(OH)2作为沉淀剂 | |
| D. | 工业生产中电解熔融氧化镁的方法制取镁 |
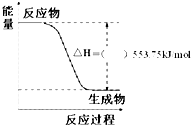
11.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 25℃、101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
8.下列变化中需加入还原剂才能实现的是( )
| A. | Cl-→Cl2 | B. | CuO→Cu | C. | Fe2+→Fe3+ | D. | H2SO4→BaSO4 |
9.从如图的溶解度曲线图,可获得的信息是( )


| A. | A、B、C三种物质中A的溶解度最大 | |
| B. | 通过蒸发溶剂的方法可将C从不饱和溶液变成饱和溶液 | |
| C. | 20℃时,100g水中溶解30g A可达到饱和 | |
| D. | 80℃时,100g水不能将50g B溶解完全,而能完全溶解50g C |
 (1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: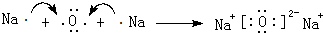 ;C、D还可形成化合物D2C2,D2C2含有的化学键类型是离子键、非极性共价键(或离子键、共价键).
;C、D还可形成化合物D2C2,D2C2含有的化学键类型是离子键、非极性共价键(或离子键、共价键).