题目内容
【题目】以熔融![]() 和
和![]() 为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
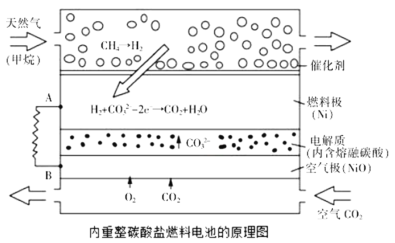
A.当外电路中通过![]() 电子时,将消耗
电子时,将消耗![]()
B.通天然气的电极为负极,发生还原反应
C.该电池使用过程中需补充![]() 和
和![]()
D.以此电池为电源电解精炼铜,当有![]() 转移时,有
转移时,有![]() 铜析出
铜析出
【答案】D
【解析】
该燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,根据图示信息知,负极的电极反应式为:H2-2e-+CO![]() =CO2+H2O,通入空气和CO2混合气体的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO
=CO2+H2O,通入空气和CO2混合气体的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO![]() ,结合原电池原理分析解答。
,结合原电池原理分析解答。
A.正极的电极反应式为O2+4e-+2CO2=2CO![]() ,当外电路中通过
,当外电路中通过![]() 电子时,将消耗0.5mol O2,但未告知是否为标准状况,因此氧气的体积不一定为11.2L,故A错误;
电子时,将消耗0.5mol O2,但未告知是否为标准状况,因此氧气的体积不一定为11.2L,故A错误;
B.通天然气的电极为原电池的负极,发生氧化反应,故B错误;
C.假设转移4mol的电子,根据电极反应:负极电极反应式为:H2-2e-+CO![]() =CO2+H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO
=CO2+H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO![]() ,负极消耗2mol的碳酸根离子,正极产生2mol的碳酸根离子,所以碳酸根离子的浓度不变,无需补充Li2CO3和K2CO3,故C错误;
,负极消耗2mol的碳酸根离子,正极产生2mol的碳酸根离子,所以碳酸根离子的浓度不变,无需补充Li2CO3和K2CO3,故C错误;
D.电解精炼铜,阴极上铜离子得到电子生成铜,电极反应式为Cu2++2e-=Cu,当电路中有0.1mol e-转移,反应生成铜0.05mol,则析出的铜的质量=0.05mol×64g/mol=3.2g,故D正确;
故选D。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
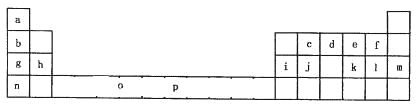
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
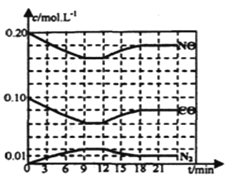
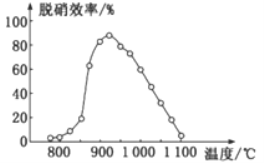
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1