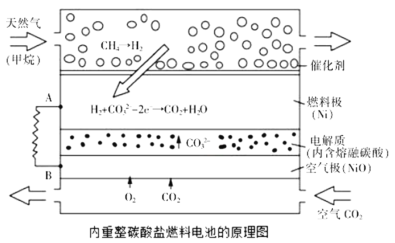
题目内容
【题目】下列操作或装置,不能达到实验目的的是( )。

A.图Ⅰ用于实验室制氨气并收集干燥的氨气
B.图Ⅱ用于检验浓硫酸与铜反应后的产物中是否含有铜离子
C.图Ⅲ用于验证牺牲阳极的阴极保护法
D.图Ⅳ用于制取![]() 晶体
晶体
【答案】B
【解析】
A.实验室用加热NH4Cl和Ca(OH)2的混合物的方法制取氨气,氨气是碱性气体,密度比空气小,用碱石灰干燥,采用向下排空气法收集,A选项不符合题意;
B.由于可能还有过剩的浓硫酸,因此在检验浓硫酸与铜反应后的产物中是否含有铜离子时应将反应后的溶液倒入水中,类似于浓硫酸的稀释,B选项符合题意;
C.原电池中锌作负极失去电子发生氧化反应,铁作正极被保护,可用K3[Fe(CN)6]来检验是否生成Fe2+从而验证牺牲阳极的阴极保护法,C选项不符合题意;
D.CO2和NH3通入饱和的氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,蘸有稀硫酸的棉花可吸收氨气,防止污染空气,D选项不符合题意;
答案选B。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
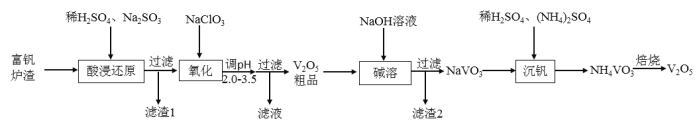
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:
已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
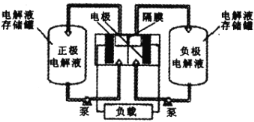
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。
【题目】在容积不变的容器中加入一定量的A和B,发生反应∶2A(g)+B(g)![]() 2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是
2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是
温度/°C | 100 | 200 | 300 | 400 | 500 |
转化率 | 30% | 75% | 75% | 50% | 18% |
A.该反应随着温度升高,反应速率先变大后变小
B.200°C,A的转化率为75%时,反应达到平衡状态
C.当单位时间内生成n mol B的同时消耗2n molC时,反应达到平衡状态
D.400°C时,B的平衡浓度为0.5 mol/L,则该反应的平衡常数K=2