题目内容
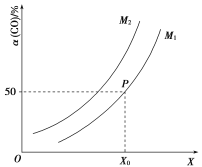
【题目】(1)汽车尾气中的 NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图。
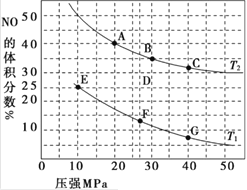
①已知该反应在较低温度下能自发进行,则反应 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
②该反应达到平衡后,为同时提高反应速率和CO的转化率,可采取的措施有______ (填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加 NO 的浓度 d.升高温度
(2)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3 和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
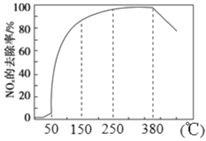
解释在50 ℃~150 ℃范围内随温度升高,NOx 的去除率迅速上升的原因是_______
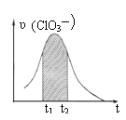
(3)NH3催化还原氮氧化物技术是目前应用最广泛的烟气脱氮技术:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂 A作用下脱氮率随温度变化如图所示。
5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂 A作用下脱氮率随温度变化如图所示。
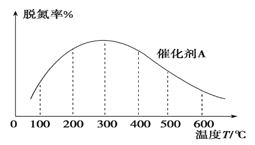
现改用催化能力稍弱的催化剂B进行实验,请在上图中画出在催化剂 B作用下的脱氮率随温度变化的曲线_________(不考虑温度对催化剂活性的影响)。
(4)某研究小组利用反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得 NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得 NO的转化率随温度的变化如图所示:
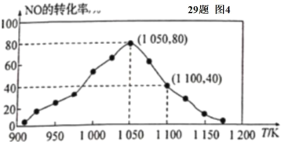
①由图可知,在 1050 K 前,反应中 NO的转化率随温度升髙而增大,其原因为____________; 在 1100 K 时,N2的体积分数为____________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp )。在 1050 K、1.1×106 Pa 时,该反应的化学平衡常数 Kp=____________(已知:气体分压(P分) =气体总压(Pa)×体积分数)
【答案】< bc 迅速上升段是催化剂活性随温度升高增大,与温度升高共同使NOx去除反应速率迅速增大 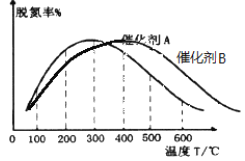 1050 K前反应未达到平衡状态,转化率没有达到最大值,随温度升高,反应速率加快,NO转化率增大 20% 4
1050 K前反应未达到平衡状态,转化率没有达到最大值,随温度升高,反应速率加快,NO转化率增大 20% 4
【解析】
(1)①根据反应自发进行的依据判断;
②为提高反应速率同时提高NO的转化率,需要改变条件平衡正向进行;
(2)在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低;
(3)脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小,B催化剂的效率低,所以达平衡的时间长,但平衡不移动,最终的脱氮率不变;
(4)①结合平衡状态特点:平衡时转化率最大,则1050 K前反应末达到平衡状态,升高温度,反应速率加快; 根据1100 K时NO的转化率为40%,利用物质反应转化关系计算出各种物质的物质的量,带入物质含量表达式即可求解;
②已知1050 K时NO的转化率为80%,设NO起始量为1 mol,根据物质反应转化关系计算各种物质的平衡物质的量,结合Kp表达式即可求解。
(1)①根据反应自由能公式△G=△H-T△S,若反应能够自发进行,则△G=△H-T△S<0,该反应的正反应是气体体积减小的反应,△S<0,反应在低温下可自发进行,则△H<0;
②根据上述分析可知:2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),ΔH<0;
N2(g)+2CO2 (g),ΔH<0;
a.改用高效催化剂加快反应速率,平衡不变,物质转化率不变,a错误;
b.缩小容器的体积,体系内压强增大,反应速率增大,平衡正向进行,NO的转化率增大,b正确;
c.增加CO的浓度反应速率增大,平衡正向进行,NO的转化率增大,c正确;
d.升高温度,反应速率增大,由于该反应的正反应为放热反应,升温平衡逆向进行,NO的转化率减小,d错误;
故合理选项是bc;
(2)在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低,根据图知,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使NOx去除反应速率迅速增大;上升阶段缓慢主要是温度升高引起的NOx去除反应速率增大但是催化剂活性下降;
(3)300℃前反应未达到平衡状态,脱氮率决定于速率,温度越高速率越快,所以脱氮率增大,300℃之后反应达平衡,脱氮率决定于平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小.B催化剂的效率低,所以达平衡的时间长,平衡不移动,但最终的脱氮率不变,所以图象为 ;
;
(4)①该反应的正反应是放热反应,反应从正反应方向开始,当达到平衡状态时反应物的转化率最高;1050 K前转化率没有达到最大值,即反应未达到平衡状态,随温度升高,反应速率加快,NO转化率增大;
在1100 K时,NO的转化率为40%,设起始量NO为2 mol,则根据反应方程式可知平衡时NO的物质的量为n(NO)=2 mol×(1-40%)=1.2 mol,n(N2)=n(CO2)=![]() △n(NO)=
△n(NO)= ![]() ×2 mol×40%=0.4 mol,所以平衡时N2的体积分数为
×2 mol×40%=0.4 mol,所以平衡时N2的体积分数为![]() ×100%=20%;
×100%=20%;
②由图可知1050K时,NO的转化率为80%,设NO起始量为1 mol,则根据物质反应转化关系可知平衡时各种物质的物质的量分别为:n(NO)=1 mol×(1-80%)=0.2 mol,n(N2)=n(CO2)=![]() △n(NO)=
△n(NO)= ![]() ×1 mol×80%=0.4 mol,气体的物质的量的比等于气体所占的压强比,平衡常数压强表示的平衡常数Kp=
×1 mol×80%=0.4 mol,气体的物质的量的比等于气体所占的压强比,平衡常数压强表示的平衡常数Kp=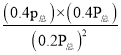 =4。
=4。

【题目】有关下图所示实验的预测现象不正确的是
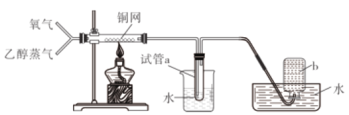
选项 | 操作 | 预测现象 |
A | 通入一段时间的氧气后点燃酒精灯 | 铜网会逐渐变黑 |
B | 通入氧气并加热一段时间后通入乙醇蒸气 | 铜网将逐渐变成红色 |
C | 预先通入氧气排净装置中的空气后再进行实验 | 集气瓶b中不会收集到气体 |
D | 观察试管a中收集到的溶液 | 溶液无色有刺激性气味 |
A.AB.BC.CD.D