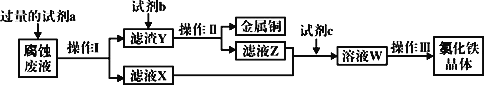
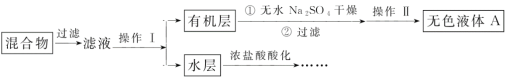
��Ŀ����
����Ŀ��25��ʱ���ı�0.1mol��L-1����RCOOH��Һ��pH����Һ��RCOOH���ӵ����ʵ���������(RCOOH)��֮�ı�[��֪��(RCOOH)=![]() ]��0.1mol��L-1����(HCOOH)��0.1mol��L-1����(CH3CH2COOH)��Һ����(RCOOH)��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(��֪���ԣ��������)( )
]��0.1mol��L-1����(HCOOH)��0.1mol��L-1����(CH3CH2COOH)��Һ����(RCOOH)��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(��֪���ԣ��������)( )

A.ͼ��M�߶�Ӧ���DZ��ᣬN�߶�Ӧ�ļ���
B.CH3CH2COONa��ˮ��ƽ�ⳣ��Kh=10-10.25
C.��Ũ�ȵ�HCOONa��CH3CH2COONa������Һ�У�c(HCOO-)+c(OH-)��c(CH3CH2COO-)+c(OH-)
D.��0.1mol/L��HCOOH��Һ��0.1mol/L��HCOONa��Һ�������ϣ�������Һ�У�c(Na+)��c(HCOOH)��c(HCOO-)��c(OH-)��c(H+)
���𰸡�C
��������
A����֪���ԣ�������ᣬ����Խǿ������̶�Խ������RCOOH������ԽС����pH=3ʱ��M������RCOOH������С��N������RCOOH����������˵��M�ĵ���̶ȴ�����Һ��ͼ��M�߶�Ӧ���Ǽ��ᣬN�߶�Ӧ�ı��ᣬ��A����
B��pH=4.88ʱ�����������ӵ����ʵ�������Ϊ50%����c(CH3CH2COOH)=c(CH3CH2COO-)�����CH3CH2COOH)CH3CH2COO-+H+������̿�֪��lgK=lgc(H+)=-4.88��������ĵ��볣��Ka��c(H+)=10��4.88��CH3CH2COONa��ˮ��ƽ�ⳣ��Kh=![]() =10-9.12����B����
=10-9.12����B����
C��HCOONa��Һ�д��ڵ���غ㣺c(HCOO-)+c(OH-)=c(Na+)+c(H+)��CH3CH2COONa����Һ�д��ڵ���غ㣺c(CH3CH2COO-)+c(OH-)=c(Na+)+c(H+)����Ũ�ȵ�HCOONa��CH3CH2COONa������Һ��c(Na+)��ȣ���֪���ԣ�������ᣬ��HCOO-��ˮ��̶�С��CH3CH2COO-��ˮ��̶ȣ� HCOONa��Һ�е�c(OH-)С��CH3CH2COONa��Һ�е�c(OH-)��HCOONa��Һ�е�c(H+)����CH3CH2COONa��Һ�е�c(H+)����HCOONa��Һ��c(Na+)+c(H+)����CH3CH2COONa��Һ�е�c(Na+)+c(H+)����c(HCOO-)+c(OH-)��c(CH3CH2COO-)+c(OH-)����C��ȷ��
D����0.1mol/L��HCOOH��Һ��0.1mol/L��HCOONa��Һ�������ϣ�������̴���ˮ����̣�������Һ�����ԣ���c(OH-)��c(H+)����D����
��ѡC��

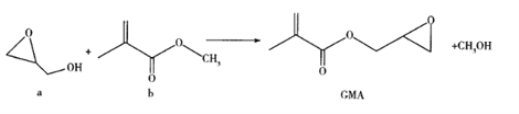
 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�����Ŀ��(1)���Ѿ���SO2���ʹ����Ϊ0.25g��L��1��ȡ300.00mL���Ѿƣ�ͨ���ʵ��ķ���ʹ����SO2ȫ���ݳ�����H2O2����ȫ������ΪH2SO4��Ȼ����0.0900mol��L��1NaOH����Һ���еζ���
�ٵζ�ǰ������ʱ��Ӧѡ����ͼ�е�___(�����)

������50mL�ζ��ܽ���ʵ�飬���ζ����е�Һ���ڿ̶���10�����������Һ������___(�����)��
��=10mL ��=40mL ��<10 mL ��>40 mL��
�������ζ�ʵ�������ζ��յ�ʱ��Һ��pH=8.8����ѡ���ָʾ��Ϊ______��ѡ���ָʾ��ʱ����жϷ�Ӧ����ζ��յ㣺______��
�ܵζ����յ�ʱ������NaOH��Һ25.00mL�������Ѿ���SO2����Ϊ___g��L��1���ζ��յ����ʱ���ӿ̶��ߣ�����������ʵ��ֵ______������ƫ��������ƫ����������Ӱ��������
(2)ijѧ����0.100molL-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ�����Ϊ��
A.��ȡ20mL����������Һע��ྻ����ƿ�У�������2��3�η�̪��
B.�ñ���Һ��ϴ�ζ���2��3�Σ�
C.��ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ���ʹ���촦������Һ��
D.ȡ��KOH��Һע���ʽ�ζ������̶���0������2��3cm ����
E.����Һ������0������0�����¿̶ȣ����¶�����
F.����ƿ���ڵζ������棬�ñ�KOH��Һ�ζ����յ㲢���¿̶ȡ�
ʵ���� | KOH��Һ��Ũ��(mol/L) | �ζ����ʱ��KOH��Һ��������(mL) | ����������Һ�����(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
����ȷ���������˳���ǣ��������ĸ��д��_________��
�ڸ����������ݣ��ɼ�����������Ũ��ԼΪ_______��������λ��Ч���֣���
����Ŀ��ijС��Ƚ�Cl-��Br-��I- �Ļ�ԭ�ԣ�ʵ�����£�
ʵ��1 | ʵ��2 | ʵ��3 | |
װ�� |
|
|
|
���� | ��Һ��ɫ�����Ա仯����պŨ��ˮ�IJ����������Թܿڣ��������� | ��Һ��ƣ���ʪKI������ֽ�����Թܿڣ����� | ��Һ������ɫ����������Һ�����ʵ� |
���ж�ʵ��ķ�������������
A. ʵ��1�У�������NH4Cl B. ����ʵ��1��ʵ��2�жϻ�ԭ�ԣ�Br-��Cl-
C. ����ʵ��3�жϻ�ԭ�ԣ�I-��Br- D. ����ʵ��������ŨH2SO4��ǿ�����ԡ��ѻӷ��Ե�����