题目内容
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率最低 |
A
解析试题分析:由X(g)+3Y(g) 2Z(g)△H<0可知,该反应是反应前后气体的物质的量增加的反应,为放热反应。根据催化剂、温度、压强对化学反应速率和化学平衡的影响来分析,若化学平衡逆向移动,则反应物的转化率降低。
2Z(g)△H<0可知,该反应是反应前后气体的物质的量增加的反应,为放热反应。根据催化剂、温度、压强对化学反应速率和化学平衡的影响来分析,若化学平衡逆向移动,则反应物的转化率降低。
因该反应是反应前后气体的物质的量不相等的反应,t2~t2时间内正逆反应速率增大且相等,则应为t2时加入了催化剂,故A正确;由图可知,t3时正逆反应速率都减小,且逆反应速率大于正反应速率,化学平衡在t3时向逆反应方向移动,而该反应为放热反应,降低温度化学平衡正向移动,故B错误;t5时正逆反应速率都增大,且逆反应速率大于正反应速率,化学平衡在t5时向逆反应方向移动,由化学计量数可知,增大压强,化学平衡应正向移动,故C错误;由图可知,t4~t5时间内v不变,化学反应处于平衡状态,平衡不移动,则反应物的转化率不变,故D错误,答案选B。
考点:考查外界条件对反应速率和平衡状态的影响、图像识别等
点评:该题是高考中的常见题型,属于中等难度的试题。试题针对性强,旨在培养学生灵活运用基础知识解决实际问题的能力。答题时明确图象中纵横左标的含义,利用反应速率的关系及化学平衡移动结合化学反应速率和化学平衡的影响因素即可解答。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:
X(g) + 2Y(g)  2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
| A.正反应和逆反应的速率都为零 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1molX同时生成0.2molZ |
在一固定体积的密闭容器中加入2 mol A和1 mol B发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
| A.4 mol A+2 mol B | B.3 mol C+1 mol D+2mol A+1 mol B |
| C.3mol C+1 mol D+1 mol B | D.3 mol C+1 mol D |
某可逆反应L(s) + G(g)  3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
| A.平衡混合气中R的质量分数 | B.达到平衡时G的转化率 |
| C.平衡混合气中G的质量分数 | D.达到平衡时L的转化率 |
下列反应中不属于可逆反应的是
A.   |
B.   |
C.  HCl + HClO HCl + HClO |
D.   |
(8分)(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 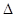 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
 2SO3(g)
2SO3(g) 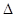 H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。 2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
| A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |

从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
 CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH