题目内容
【题目】煤燃烧排放的烟气含有 SO2和 NOx,形成酸雨、污染大气。
(1)采用 NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 SO2和 NO 的烟气,写出 NaClO2溶液脱硝过程中主要反应的离子方程式______________.
(2)NO2与SO2能发生反应:NO2+SO2 ![]() SO3+NO,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(N02) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。 部分实验结果如图所示:
SO3+NO,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(N02) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。 部分实验结果如图所示:
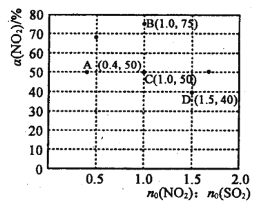
①当容器内________(填标号)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.N02的体积分数
e.气体的颜色
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是__________。
③图中C、D两点对应的实验温度分别为Tc和Td,试判断: Tc_____Td(填“>”、“=”或“<”)。
(3)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g) + O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则 NO2(g)+SO2(g) ![]() SO3(g)+NO(g) △H= ________.
SO3(g)+NO(g) △H= ________.
【答案】4NO + 3ClO2 -+ 4OH- =4NO3 - + 3Cl-+ 2H2O de 降温 = -41.8kJ/mol
【解析】
(1)碱性条件下,NaClO2溶液与NO反应生成硝酸根、氯离子和水;
(2)①根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
②降低温度,平衡向吸热反应方向移动;
③温度不变,化学平衡常数不变;
(3)依据盖斯定律计算。
(1)亚氯酸钠具有氧化性,且NaClO2溶液呈碱性,脱硝过程中NaClO2溶液与NO反应生成硝酸根、氯离子和水,反应的离子方程式为3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O,故答案为:3ClO2-+4NO+4OH-
=4NO3-+3Cl-+2H2O;
(2)①该反应是气体体积不变的反应,无论是否达到平衡,气体物质的量、气体的压强、气体的平均摩尔质量不变,不能作为判断反应达到了化学平衡状态的依据;由质量守恒定律可知反应前后气体质量不变,恒容容器中,无论是否达到平衡,气体密度不变,不能作为判断反应达到了化学平衡状态的依据,故答案为:de;
②该反应是一个气体体积不变的放热反应,B点和C点的n0(N02) : n0 (SO2)相同,由图可知NO2的平衡转化率减小,则将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是降低温度,故答案为:降温;
③设C点和D点n0 (SO2)均为1mol,容器体积为1L,则C点平衡时,c(SO2)、c(NO2)、c(NO)、c(SO3)均为0.5mol/L,平衡常数为1;D点平衡时,c(NO2)为0.9 mol/L 、c(SO2)为0.4 mol/L 、c(NO)、c(SO3)均为0.6mol/L,平衡常数为1,C点和D点平衡常数相等,说明反应温度相同,故答案为:=;
(3)将已知已知反应依次编号为:①2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1,根据盖斯定律可知将(①②)/2可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H= (196.6+113)/2=-41.8 kJmol-1,故答案为:-41.8。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到科学家的不断关注,下列为制取Cu2O的三种方法:
方法Ⅰ | 用碳粉在高温条件下还原CuO |
方法Ⅱ | 电解法,原理为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_________________________ 。
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________ ;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过离子交换膜的阴离子的物质的量为________mol。(离子交换膜只允许OH-通过)
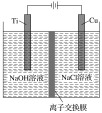
(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为________________。
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:___________________________。