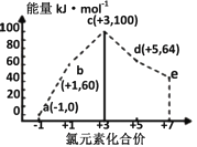
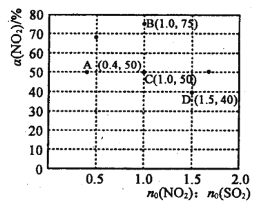
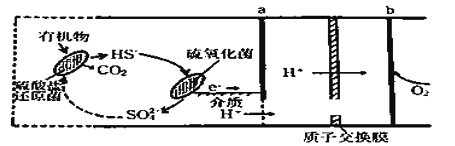
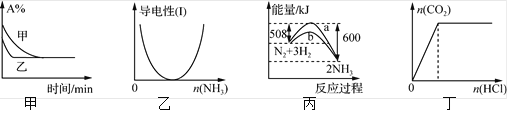
题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到科学家的不断关注,下列为制取Cu2O的三种方法:
方法Ⅰ | 用碳粉在高温条件下还原CuO |
方法Ⅱ | 电解法,原理为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_________________________ 。
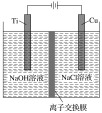
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________ ;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过离子交换膜的阴离子的物质的量为________mol。(离子交换膜只允许OH-通过)
(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为________________。
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:___________________________。
【答案】反应不易控制,Cu2O可能被C继续还原为Cu2Cu-2e-+2OH-===Cu2O+H2O0.012molN2H4+4OH--4e-=4H2O+N2↑
【解析】
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是C还原CuO生成的Cu2O可能被C继续还原为Cu,反应不易受控制。(2)阳极Cu失去电子发生氧化反应,2Cu-2e-+2OH-=Cu2O+H2O。电池阴极的反应式为2H2O+2e-=H2↑+2OH-,阴极生成的气体为H2,标准状况下生成气体的物质的量为0.005mol,所以通过离子交换膜的阴离子的物质的量为0.01mol。(3)方法Ⅲ的化学反应方程式为N2H4+4Cu(OH)2=2 Cu2O+6H2O+N2↑,由化学方程式可知,生成1molN2时,同时生成Cu2O的物质的量为2mol。(4)燃料负极失去电子发生氧化反应,电极方程式为N2H4+4OH--4e-=4H2O+N2↑。