题目内容
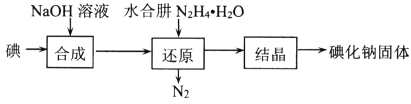
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
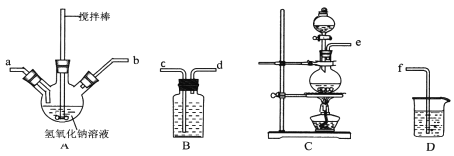
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。

(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
【答案】(1)Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O(2分)(2)B(1分)
(3)2Fe2++H2O2+2H+= 2Fe3++2H2O(2分)
(4)静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。(其它合理答案)(2分)
(5)2.5×10-5(2分)
(6)①N2(1分)②2MnO4- +5SO2+2H2O=2Mn2++5SO42-+4H+(2分)
【解析】试题(1)铝灰中氧化铝与硫酸反应的化学方程式为Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O;
(2)FeO、Fe2O3和氧化铝溶于酸,二氧化硅不溶形成滤渣,二氧化硅和NaOH焙烧制备硅酸钠,不能用玻璃和瓷质容器,所以可采用的装置为B;
(3)过滤后滤液中存在Fe2+、Fe3+,Al3+,加30%的H2O2溶液会氧化Fe2+,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)在被氧化后的溶液中加入了K4[Fe(CN)6]溶液把Fe3+沉淀,验证溶液中是否还含有铁离子的操作方法为静置,待溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含铁元素,反之则有;
(5)Ksp[Fe(OH)3]=4.0×10-38,即c(Fe3+)c3(OH-)=4.0×10-38,该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数K=c3(H+)/c(Fe3+)=Kw3/c(Fe3+)c3(OH-)=(10-14)3/4.0×10-38=2.5×10-5;
Fe(OH)3+3H+的平衡常数K=c3(H+)/c(Fe3+)=Kw3/c(Fe3+)c3(OH-)=(10-14)3/4.0×10-38=2.5×10-5;
(6)①通过饱和亚硫酸氢钠溶液除去氨气、三氧化硫,通过高锰酸钾溶液除去二氧化硫气体,故收集的气体为N2;②KMnO4溶液与二氧化硫反应,离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。

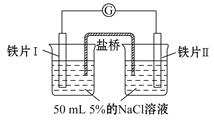
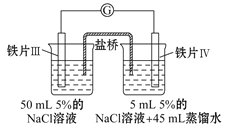
【题目】某同学做了如下实验:
装置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中正确的是
A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转
B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C.铁片Ⅰ、Ⅲ的腐蚀速率相等
D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀