题目内容
【题目】(1)对于下列反应:2SO2+O2 2SO3,如果 2min 内 SO2 的浓度由 6mol/L 下降为 2mol/L,那么,用 SO2 浓度变化来表示的化学反应速率为______,用 O2 浓度变化来表示的反应速率为______。如果开始时 SO2 浓度为 4mol/L,2min 后反应达平衡,若这段时间内v(O2)为 0.5mol/(Lmin),那么 2min 时 SO2 的浓度为______。
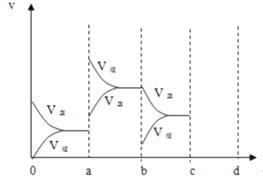
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是___________;bc 过程中改变的条件可能是____________;若在 c 时刻增大压强,画出 c~d 时刻反应速率变化情况____________。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是___________;bc 过程中改变的条件可能是____________;若在 c 时刻增大压强,画出 c~d 时刻反应速率变化情况____________。
【答案】 2mol/L.min-1;; 1mol/L.min-1 2mol/L 升高温度 减少 SO3 的浓度 
【解析】本题主要考查影响化学反应速率的因素。
(1)对于下列反应:2SO2+O22SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为(6mol/L-2mol/L)/2min=2mol/L.min-1,用 O2浓度变化来表示的反应速率为SO2的1/2为1mol/L.min-1。如果开始时 SO2 浓度为 4mol/L,2min 后反应达平衡,若这段时间内v(O2)为 0.5mol/(Lmin),由此可知O2的物质的量浓度减少1mol/L,相应地SO2的物质的量浓度减少2mol/L,那么 2min 时 SO2 的浓度为2mol/L。
(2)a时刻正、逆反应速率都增大,而且逆反应速率增大程度更大,说明ab过程中改变的条件可能是升高温度;b时刻逆反应速率减小,正反应速率不变,所以bc 过程中改变的条件可能是减少 SO3 的浓度;若在 c 时刻增大压强,c~d 时刻反应速率变化情况为: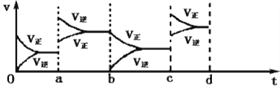 。
。

 名校课堂系列答案
名校课堂系列答案【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。