题目内容
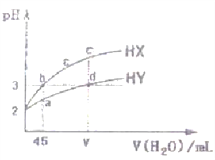
【题目】某温度下,分别向10 mL浓度均为0.1mol/L的CuCl2和ZnCl2溶液中滴加0.1mol/L的Na2S 溶液,滴加过程中溶液中-1gc(Cu2+)和-lgc(Zn2+)与Na2S 溶液体积(V)的关系如图所示。(已知: Ksp(ZnS) > Ksp(CuS),1g3≈0.5) 下列有关说法错误的是
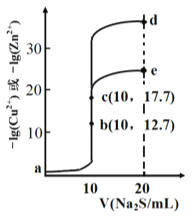
A. 溶液pH:a<b<e B. a 点的ZnCl2 溶液中: c(Cl-)<2[c(Zn2+)+c(H+)]
C. a-b-e为滴定CuCl2溶液的曲线 D. d点纵坐标小于34.9
【答案】C
【解析】A、a溶液中Zn2+和Cu2+离子水解,溶液显酸性,分别加入硫化钠生成沉淀,b点接近中性,c点为Na2S溶液,溶液显碱性,故溶液pH:a<b<e,选项A正确;B. a点的ZnCl2溶液显酸性,且存在电荷守恒有c(Cl-)=2c(Zn2+)+c(H+)-c(OH-)<2[c(Zn2+)+c(H+)],选项B正确;C、Ksp(ZnS)>Ksp(CuS),硫离子浓度相同时,-1gc(Cu2+)<lgc(Zn2+),故a-b-e为滴定Zn Cl2溶液的曲线,选项C错误;D. 10mL浓度均为0.1mol/L的CuCl2和ZnCl2溶液中滴加0.1mol/L的Na2S溶液10mL达到滴定终点,则-lgc(Zn2+)=17.7,Ksp(ZnS)=10-35.4,d点时若c(S2-)=![]() 0.1mol/L,c(Zn2+)=
0.1mol/L,c(Zn2+)=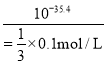 =10-34.9,故d点纵坐标小于34.9,选项D正确。答案选C。
=10-34.9,故d点纵坐标小于34.9,选项D正确。答案选C。

【题目】高铁酸钾(K2FeO4) 易溶于水。受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种的主要步骤如图所示(方框内为主产物)。
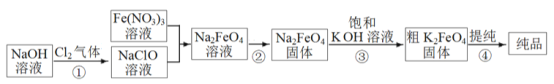
(1)①中反应的离子方程式是_____________________________。
(2)③中的反应为: Na2FeO4(s)+2KOH(aq) ![]() K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
(3) 提纯粗K2FeO4采用的方法是___________________(选填“萃取”、“蒸馏”、“重结晶”)。提纯过程中溶解粗K2FeO4 固体应选用__________(填序号)。
A.水 B.稀硫酸 C.KOH 溶液 D.NaOH 溶液
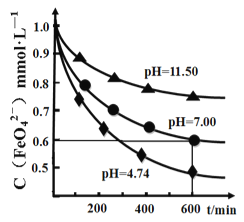
(4)某温度下,高铁酸钾溶液在不同pH 下的分解曲线如图所示。为延长高铁酸钾溶液的保存时间,可采取的措施是________________;完成pH>7 时的化学反应方程式配平:__ K2FeO4 +___=___KOH+___Fe(OH)3↓+________,____________________
(5)用高铁酸钾处理污水,能去污、杀菌、消毒,且自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现用两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30mg K2FeO4,相同温度下最终去除效果见下表。
项目 | 葡萄糖溶液 | 甲苯溶液 |
起始COD/(mg·L-1) | 1124 | 1966 |
处理后COD/(mg·L-1) | 983 | 526 |
去除率/% | 11.54 | 73.24 |
已知: 化学需氧量(COD) 指的是: 在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧气的亳克数,以mg·L-1表示。该指标也作为污水中有机物含量的综合指标之一。由甲苯引起的1L 污水,当去除率为73.24%时,理论上需高铁酸钾_____mg。[ 已知 :M(K2FeO4)=198g/mol]。理论上需要的m (Na2FeO4 ) 大于实际用量,说明Na2FeO4 去除有机污水的原理除了氧化作用外,另一个原因可能是_____________________________。