题目内容
【题目】高铁酸钾(K2FeO4) 易溶于水。受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种的主要步骤如图所示(方框内为主产物)。
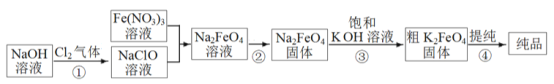
(1)①中反应的离子方程式是_____________________________。
(2)③中的反应为: Na2FeO4(s)+2KOH(aq) ![]() K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
(3) 提纯粗K2FeO4采用的方法是___________________(选填“萃取”、“蒸馏”、“重结晶”)。提纯过程中溶解粗K2FeO4 固体应选用__________(填序号)。
A.水 B.稀硫酸 C.KOH 溶液 D.NaOH 溶液
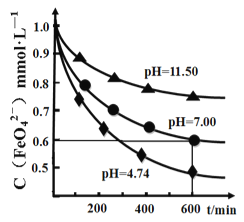
(4)某温度下,高铁酸钾溶液在不同pH 下的分解曲线如图所示。为延长高铁酸钾溶液的保存时间,可采取的措施是________________;完成pH>7 时的化学反应方程式配平:__ K2FeO4 +___=___KOH+___Fe(OH)3↓+________,____________________
(5)用高铁酸钾处理污水,能去污、杀菌、消毒,且自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现用两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30mg K2FeO4,相同温度下最终去除效果见下表。
项目 | 葡萄糖溶液 | 甲苯溶液 |
起始COD/(mg·L-1) | 1124 | 1966 |
处理后COD/(mg·L-1) | 983 | 526 |
去除率/% | 11.54 | 73.24 |
已知: 化学需氧量(COD) 指的是: 在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧气的亳克数,以mg·L-1表示。该指标也作为污水中有机物含量的综合指标之一。由甲苯引起的1L 污水,当去除率为73.24%时,理论上需高铁酸钾_____mg。[ 已知 :M(K2FeO4)=198g/mol]。理论上需要的m (Na2FeO4 ) 大于实际用量,说明Na2FeO4 去除有机污水的原理除了氧化作用外,另一个原因可能是_____________________________。
【答案】 Cl2+2OH-=Cl-+ClO-+H2O K2FeO4的溶解度比Na2FeO4小 增大K+离子浓度,平衡向右移动,有利于K2FeO4生成 重结晶 C 降低温度和升高溶液的pH 4 K2FeO4+10H2O=8KOH+4Fe(OH)3↓+3O2↑ 1.188×104(或11880、1.2×104等) K2FeO4还原生成的Fe3+离子水解生成Fe(OH)3胶体,对有机物的吸附而除去(或Fe(OH)3胶体有吸附作用)
【解析】(1)①中氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;(2)③中的反应为:Na2FeO4(s)+2KOH(aq) ![]() K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是K2FeO4的溶解度比Na2FeO4小;用饱和KOH溶液的目的除了减少K2FeO4的溶解外,还有增大K+离子浓度,平衡向右移动,有利于K2FeO4生成;(3)提纯粗K2FeO4采用的方法是重结晶、洗涤、低温烘干的方法;K2FeO4固体在水、稀硫酸、NaOH溶液中的溶解度均较大,故提纯过程中溶解粗K2FeO4固体应选用KOH溶液中,答案选C;(4)根据图中信息可知,温度越低,pH越大c(FeO42-)较大,为延长高铁酸钾溶液的保存时间,可采取的措施是降低温度和升高溶液的pH; pH>7时为碱性,根据氧化还原反应及质量守恒进行配平,化学反应方程式为4 K2FeO4+10H2O=8KOH+4Fe(OH)3↓+3O2↑;由甲苯引起的1L污水,当去除率为73.24%时,COD为(1966-526)mg,根据得失电子守恒有(1966-526)
K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是K2FeO4的溶解度比Na2FeO4小;用饱和KOH溶液的目的除了减少K2FeO4的溶解外,还有增大K+离子浓度,平衡向右移动,有利于K2FeO4生成;(3)提纯粗K2FeO4采用的方法是重结晶、洗涤、低温烘干的方法;K2FeO4固体在水、稀硫酸、NaOH溶液中的溶解度均较大,故提纯过程中溶解粗K2FeO4固体应选用KOH溶液中,答案选C;(4)根据图中信息可知,温度越低,pH越大c(FeO42-)较大,为延长高铁酸钾溶液的保存时间,可采取的措施是降低温度和升高溶液的pH; pH>7时为碱性,根据氧化还原反应及质量守恒进行配平,化学反应方程式为4 K2FeO4+10H2O=8KOH+4Fe(OH)3↓+3O2↑;由甲苯引起的1L污水,当去除率为73.24%时,COD为(1966-526)mg,根据得失电子守恒有(1966-526)![]() ,
,![]() 理论上需高铁酸钾11880mg;理论上需要的m(Na2FeO4)大于实际用量,说明Na2FeO4去除有机污水的原理除了氧化作用外,另一个原因可能是K2FeO4还原生成的Fe3+离子水解生成Fe(OH)3胶体,对有机物的吸附而除去(或Fe(OH)3胶体有吸附作用)。
理论上需高铁酸钾11880mg;理论上需要的m(Na2FeO4)大于实际用量,说明Na2FeO4去除有机污水的原理除了氧化作用外,另一个原因可能是K2FeO4还原生成的Fe3+离子水解生成Fe(OH)3胶体,对有机物的吸附而除去(或Fe(OH)3胶体有吸附作用)。

【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
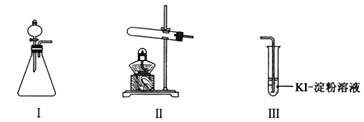
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。