题目内容
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
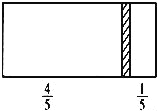
A.右边CO与CO2分子数之比为1:3
B.右侧气体密度是相同条件下氢气密度的18倍
C.右侧CO的质量为1.75g
D.若隔板处于距离右端![]() 处,其他条件不变,则前后两次压强之比为25:24
处,其他条件不变,则前后两次压强之比为25:24
【答案】D
【解析】
试题分析:当左边充入1molN2,右边充入CO和CO2的混合气体共8g,左、右室的压强相等,则右室中CO和CO2的总物质的量为1mol×![]() =0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:
=0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:![]() ,解得x=0.1875、y=0.0625.
,解得x=0.1875、y=0.0625.
A.分子数目之比等于物质的量之比;
B.根据![]() =
=![]() 计算平均摩尔质量,相同条件下气体密度之比等于其摩尔质量之比;
计算平均摩尔质量,相同条件下气体密度之比等于其摩尔质量之比;
C.根据m=nM计算CO的质量;
D.若隔板处于距离右端![]() 处,则右室气体物质的量为1mol×
处,则右室气体物质的量为1mol×![]() =0.2mol,由PV=nRT可得P=cRT,则恒温条件下压强之比等于气体总浓度之比.
=0.2mol,由PV=nRT可得P=cRT,则恒温条件下压强之比等于气体总浓度之比.
解:当左边充入1molN2,右边充入CO和CO2的混合气体共8g,左、右室的压强相等,则右室中CO和CO2的总物质的量为1mol×![]() =0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:
=0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:![]() ,解得x=0.1875、y=0.0625.
,解得x=0.1875、y=0.0625.
A.分子数目之比等于物质的量之比,右边CO与CO2分子数之比为0.187mol:0.0625mol=3:1,故A错误;
B.由此气体的平均摩尔质量为![]() =32g/mol,相同条件下气体密度之比等于其摩尔质量之比,故右侧气体密度是相同条件下氢气密度的
=32g/mol,相同条件下气体密度之比等于其摩尔质量之比,故右侧气体密度是相同条件下氢气密度的![]() =16倍,故B错误;
=16倍,故B错误;
C.CO的质量为0.1875mol×28g/mol=5.25g,故C错误;
D.由PV=nRT可得P=cRT,则恒温条件下压强之比等于气体总浓度之比,若隔板处于距离右端![]() 处,则右室气体物质的量为1mol×
处,则右室气体物质的量为1mol×![]() =0.2mol,则前后两次压强之比为
=0.2mol,则前后两次压强之比为![]() :
:![]() =25:24,故D正确,
=25:24,故D正确,
故选:D.

 阅读快车系列答案
阅读快车系列答案