ЬтФПФкШн
ЁОЬтФПЁПЙЄвЕжЦЕУЕФЕЊЛЏТСЃЈAlNЃЉВњЦЗжаГЃКЌгаЩйСПAl4C3ЁЂAl2O3ЁЂCЕШдгжЪЃЎФГЭЌбЇЩшМЦСЫШчЯТЪЕбщЗжБ№ВтЖЈЕЊЛЏТСЃЈAlNЃЉбљЦЗжаAlNКЭAl4C3ЕФжЪСПЗжЪ§ЃЈКіТдNH3дкЧПМюадШмвКжаЕФШмНтЃЉЃЎ
ЃЈ1ЃЉЪЕбщдРэЃКЂйAl4C3гыСђЫсЗДгІПЩЩњГЩCH4ЃЛЂкAlNШмгкЧПЫсВњЩњяЇбЮЃЌШмгкЧПМюЩњГЩАБЦјЃЎаДГіAl4C3гыСђЫсЗДгІЕФЛЏбЇЗНГЬ ЃЎ
ЃЈ2ЃЉЪЕбщзАжУЃЈШчЭМЫљЪОЃЉЃК

ЃЈ3ЃЉЪЕбщЙ§ГЬЃК
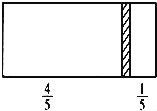
ЂйСЌНгЪЕбщзАжУЃЌМьбщзАжУЕФЦјУмадЃЎГЦЕУDзАжУЕФжЪСПЮЊygЃЌЕЮЖЈЙмЕФЖСЪ§ЮЊamLЃЛ
ЂкГЦШЁxgAlNбљЦЗжУгкзАжУBЦПжаЃЛШћКУНКШћЃЌЙиБеЛюШћK2ЁЂK3ЃЌДђПЊЛюШћK1ЃЌЭЈЙ§ЗжвКТЉЖЗМгШыЯЁСђЫсЃЌгызАжУBЦПФкЮяжЪГфЗжЗДгІЃЛ
ЂлД§ЗДгІНјааЭъШЋКѓЃЌЙиБеЛюШћK1ЃЌДђПЊЛюШћK3ЃЌЭЈЙ§ЗжвКТЉЖЗМгШыЙ§СПNaOHЃЌгызАжУBЦПФкЮяжЪГфЗжЗДгІЃЛ
Ђм ЃЈЬюШыИУВНгІНјааЕФВйзїЃЉЃЛ
ЂнМЧТМЕЮЖЈЙмЕФЖСЪ§ЮЊbmLЃЌГЦЕУDзАжУЕФжЪСПЮЊzgЃЎ
ЃЈ4ЃЉЪ§ОнЗжЮіЃКЃЈвбжЊЃКИУЪЕбщЬѕМўЯТЕФЦјЬхФІЖћЬхЛ§ЮЊVm LmolЉ1ЃЉ
ЂйAl4C3ЕФжЪСПЗжЪ§ЮЊ ЃЛ
ЂкШєЖСШЁЕЮЖЈЙмжаЦјЬхЕФЬхЛ§ЪБЃЌвКУцзѓИпгвЕЭЃЌдђЫљВтЦјЬхЕФЬхЛ§ ЃЈЬюЁАЦЋДѓЁБЁЂЁАЦЋаЁЁБЛђЁАЮогАЯьЁБЯТЭЌЃЉЃЎШєЗжвКТЉЖЗКЭЮќТЫЦПМфУЛгагУЯ№НКЙмСЌЭЈЃЌдђЫљВтЦјЬхЕФЬхЛ§ ЃЛ
ЂлAlNЕФжЪСПЗжЪ§ЮЊ ЃЎ
ЁОД№АИЁПЃЈ1ЃЉAlN+NaOH+H2O=NaAlO2+NH3ЁќЃЛ
ЃЈ3ЃЉДђПЊK2ЃЌЭЈШыПеЦјвЛЖЮЪБМфЃЛ
ЃЈ4ЃЉЂй![]() ЁС100%ЃЎ
ЁС100%ЃЎ
ЂкЦЋаЁЃЛЦЋДѓЃЛ
Ђл![]() ЁС100%ЃЎ
ЁС100%ЃЎ
ЁОНтЮіЁП
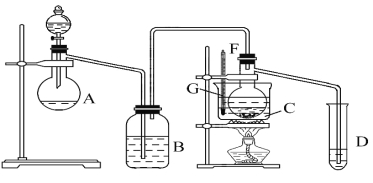
ЪдЬтЗжЮіЃКДгЪЕбщзАжУКЭЪЕбщВНжшЩЯПДЃЌБОЪЕбщЕФдРэЪЧгУзуСПСђЫсгыбљЦЗжаAl4C3ЭъШЋЗДгІЃЌСПШЁЩњГЩЕФМзЭщЦјЬхЃЌДгЖјПЩВтЕУAl4C3ЕФАйЗжКЌСПЃЛгУзуСПNaOHШмвКгыбљЦЗжаAlNЭъШЋЗДгІЃЌГфЗжЮќЪеЩњГЩЕФАБЦјЃЌВЂГЦСПЦфжЪСПЃЌДгЖјЧѓЕУAlNЕФжЪСПЗжЪ§ЃЌвдДЫЗжЮіНтД№ЃЛ
ЃЈ1ЃЉЂкИљОнЬтФПаХЯЂЃКAlNШмгкЧПМюШмвКЪБЛсЩњГЩNH3РДЪщаДЗНГЬЪНЃЛ
ЃЈ3ЃЉЂмзАжУжаВаСєВПЗжАБЦјЃЌДђПЊK2ЃЌЭЈШыПеЦјвЛЖЮЪБМфЃЌХХОЁзАжУЕФАБЦјЃЌБЛзАжУDЭъШЋЮќЪеЃЛ
ЃЈ4ЃЉЂйИљОнЕЊдзгЕФЪиКуЃЌАБЦјЕФЮяжЪЕФСПЕШгкAlNЕФЮяжЪЕФСПЃЌПЩЧѓЕУAlNЕФжЪСПЗжЪ§ЃЛ
ЂкЖСШЁЕЮЖЈЙмжаЦјЬхЕФЬхЛ§ЪБЃЌвКУцзѓИпгвЕЭЃЌЦјЬхЕФбЙЧПДѓгкДѓЦјбЙЃЌВтЖЈЦјЬхМзЭщЕФЬхЛ§ЦЋаЁЃЛШчЙћзАжУУЛгаЯ№НКЙмЃЌЫцвКЬхСїЯТЪдЙмжабЙЧПдіДѓЃЌдкХХвКЙ§ГЬжаЛсХХГіЕФвКЬхдіЖрЃЌЕМжТВтЖЈНсЙћЦЋИпЃЛ
ЂлИљОнЬМдзгЕФЪиКуЃЌAl4C3ЕФЮяжЪЕФСПЕШгкМзЭщЕФЮяжЪЕФСПЕФШ§ЗжжЎвЛЃЌПЩЧѓЕУAl4C3ЕФжЪСПЗжЪ§ЃЎ
НтЃКДгЪЕбщзАжУКЭЪЕбщВНжшЩЯПДЃЌБОЪЕбщЕФдРэЪЧгУзуСПСђЫсгыбљЦЗжаAl4C3ЭъШЋЗДгІЃЌСПШЁЩњГЩЕФМзЭщЦјЬхЃЌДгЖјПЩВтЕУAl4C3ЕФАйЗжКЌСПЃЛгУзуСПNaOHШмвКгыбљЦЗжаAlNЭъШЋЗДгІЃЌГфЗжЮќЪеЩњГЩЕФАБЦјЃЌВЂГЦСПЦфжЪСПЃЌДгЖјЧѓЕУAlNЕФжЪСПЗжЪ§ЃЛ
ЃЈ1ЃЉИљОнЬтФПаХЯЂЃКAlNШмгкЧПМюШмвКЪБЛсЩњГЩNH3ЃЌЛЏбЇЗНГЬЪНЮЊЃКAlN+NaOH+H2O=NaAlO2+NH3ЁќЃЌ
ЙЪД№АИЮЊЃКAlN+NaOH+H2O=NaAlO2+NH3ЁќЃЛ
ЃЈ3ЃЉЂмзАжУжаВаСєВПЗжАБЦјЃЌДђПЊK2ЃЌЭЈШыПеЦјвЛЖЮЪБМфЃЌХХОЁзАжУЕФАБЦјЃЌБЛзАжУDЭъШЋЮќЪеЃЌЗРжЙВтЖЈЕФАБЦјЕФжЪСПЦЋаЁЃЌ
ЙЪД№АИЮЊЃКДђПЊK2ЃЌЭЈШыПеЦјвЛЖЮЪБМфЃЛ
ЃЈ4ЃЉЂйМзЭщЕФЬхЛ§ЮЊЃЈaЉbЃЉmLЃЌЮяжЪЕФСПЮЊ![]() molЃЌИљОнЬМдзгЕФЪиКуЃЌAl4C3ЕФЮяжЪЕФСПЕШгкМзЭщЕФЮяжЪЕФСПЕФШ§ЗжжЎвЛЃЌЫљвдAl4C3ЕФжЪСПЮЊ
molЃЌИљОнЬМдзгЕФЪиКуЃЌAl4C3ЕФЮяжЪЕФСПЕШгкМзЭщЕФЮяжЪЕФСПЕФШ§ЗжжЎвЛЃЌЫљвдAl4C3ЕФжЪСПЮЊ![]() ЁС
ЁС![]() molЁС144g/mol=
molЁС144g/mol=![]() gЃЌAl4C3ЕФжЪСПЗжЪ§ЮЊ
gЃЌAl4C3ЕФжЪСПЗжЪ§ЮЊ![]() ЁС100%ЃЌ
ЁС100%ЃЌ
ЙЪД№АИЮЊЃК![]() ЁС100%ЃЎ
ЁС100%ЃЎ
ЂкЖСШЁЕЮЖЈЙмжаЦјЬхЕФЬхЛ§ЪБЃЌвКУцзѓИпгвЕЭЃЌЦјЬхЕФбЙЧПДѓгкДѓЦјбЙЃЌВтЖЈЦјЬхМзЭщЕФЬхЛ§ЦЋаЁЃЌЯ№НКЙмПЩвдЦНКтбЙЧПШУвКЬхЫГРћЕЮШыЪдЙмжаЃЌЛЙПЩвдЦ№ЕННЕЕЭЪЕбщЮѓВюЕФзїгУЃЌШчЙћзАжУжаУЛгаЯ№НКЙмЃЌЫцвКЬхСїЯТЪдЙмжабЙЧПдіДѓЃЌЪдЙмжаХХГівКЬхдіЖрЃЌВтСПГіЕФИУЮяжЪАйЗжКЌСПНЋЛсЦЋДѓЃЌ
ЙЪД№АИЮЊЃКЦЋаЁЃЛЦЋДѓЃЛ
ЂлАБЦјЕФжЪСПЮЊЃЈzЉyЃЉgЃЌЮяжЪЕФСПЮЊ![]() molЃЌИљОнЕЊдзгЕФЪиКуЃЌАБЦјЕФЮяжЪЕФСПЕШгкAlNЕФЮяжЪЕФСПЃЌЫљвдAlNЕФжЪСПЮЊ
molЃЌИљОнЕЊдзгЕФЪиКуЃЌАБЦјЕФЮяжЪЕФСПЕШгкAlNЕФЮяжЪЕФСПЃЌЫљвдAlNЕФжЪСПЮЊ![]() molЁС41g/mol=
molЁС41g/mol=![]() gЃЌЙЪAlNЕФжЪСПЗжЪ§ЮЊ
gЃЌЙЪAlNЕФжЪСПЗжЪ§ЮЊ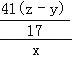 ЁС100%=
ЁС100%=![]() ЁС100%ЃЌ
ЁС100%ЃЌ
ЙЪД№АИЮЊЃК![]() ЁС100%ЃЎ
ЁС100%ЃЎ

ЁОЬтФПЁПдЊЫижмЦкБэЪЧбЇЯАЛЏбЇЕФживЊЙЄОпЃЌЫќвўКЌзХаэЖраХЯЂКЭЙцТЩЃЎЯТБэЫљСаЪЧЮхжжЖЬжмЦкЕФдзгАыОЖМАжївЊЛЏКЯМлЃЈвбжЊюыЕФдзгАыОЖЮЊ0.089nmЃЉ
дЊЫиДњКХ | A | B | C | D | E |
дзгАыОЖ/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
жївЊЛЏКЯМл | +2 | +3 | +6ЁЂЉ2 | Љ1 | Љ2 |
ЃЈ1ЃЉAКЭEСНдЊЫизщГЩЕФЛЏКЯЮяЕФЕчзгЪН ЃЎ
ЃЈ2ЃЉBЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮягыCЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЗДгІЕФРызгЗНГЬЪНЮЊЃК
ЃЈ3ЃЉЩЯЪіЮхжждЊЫиЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФЫсадзюЧПЕФЪЧ ЃЈЬюЛЏбЇЪНЃЉ
ЃЈ4ЃЉCКЭEаЮГЩЕФЛЏКЯЮяжаОпгаЛЙдадЕФЪЧ ЃЈЬюЛЏбЇЪНЃЉЃЎ
ЃЈ5ЃЉAКЭDЫљаЮГЩЛЏКЯЮяЕФОЇЬхРраЭЃК ЃЎ