题目内容
【题目】一氯胺(NH2Cl,Cl呈+1价)可用于制备液体火箭燃料偏二甲肼。
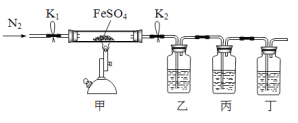
实验一:制备NH2Cl实验室制备一氯胺可用氨气与次氯酸钠反应,反应方程式为NH3+NaClO=NH2Cl+NaOH。某实验小组设计如下装置制备NH2Cl。
(1)B装置的作用为_________________
(2)C中盛装的是饱和食盐水,则惰性电极b应与电源_______极相连。
(3)先电解一段时间后,接下来的实验操作是______。
实验二:检测自来水中的一氯胺的含量.一氯胺是重要的水消毒剂,利用碘量法可以检测自来水中一氯胺的含量.其主要方法为:取已加入一氯胺的自来水20.00mL.加入过量的碘化钾溶液,充分反应后,用0.100 mol/L的Na2S2O3溶液进行滴定,达到终点时,消耗Na2S2O3溶液5.00 mL。
已知:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3- I3-![]() I2+I- I2+2S2O32-=2I-+S4O62-
I2+I- I2+2S2O32-=2I-+S4O62-
(4)滴定时用___作指示剂,判定达到滴定终点的现象是___________。
(5)该自来水中一氯胺的浓度为____________mol/L。
【答案】安全瓶 正 先打开止水夹,再打开分液漏斗的活塞 淀粉 溶液由蓝色变为无色,且半分钟颜色不再变化 0.0125
【解析】
(1)根据氨气极易溶于水,容易倒吸;
(2)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠,阴离子在阳极放电,与电源的正极相连;
(3)电解一段时间后,应制备氨气并通入到C中与次氯酸钠反应;
(4)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
(5)由方程式:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3-、I3-![]() I2+I-、I2+2S2O32-═2I-+S4O62-可得到关系式:NH2Cl~I3-~I2~2S2O32-进行计算。
I2+I-、I2+2S2O32-═2I-+S4O62-可得到关系式:NH2Cl~I3-~I2~2S2O32-进行计算。
(1)根据氨气极易溶于水,容易倒吸,所以B装置的作用为安全瓶;
(2)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠,氯离子在阳极放电,所以b是阳极,与电源的正极相连;
(3)先电解一段时间后,接下来的实验操作通入制备氨气并通入到C中,即先打开止水夹,再打开分液漏斗的活塞;
(4)碘遇淀粉变蓝色,故选择淀粉作指示剂,判定达到滴定终点的现象是当溶液由蓝色变为无色,且半分钟颜色不再变化;
(5)由方程式:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3-、I3-![]() I2+I-、I2+2S2O32-=2I-+S4O62-;
I2+I-、I2+2S2O32-=2I-+S4O62-;
可得到关系式:NH2Cl~I3-~I2 ~2S2O32-;
n(Na2S2O3)=2n(NH2Cl),2×c(NH2Cl)×20×10-3L=0.100 mol/L×5×10-3L,
解得:c(NH2Cl)=0.0125mol/L。

【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1