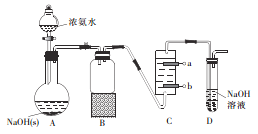
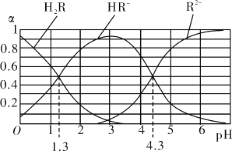
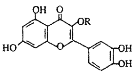
题目内容
【题目】已知:2FeSO4![]() Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
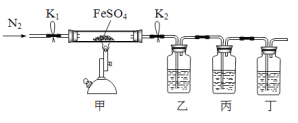
A. 乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液
B. 实验开始时,先打开K1和K2,缓缓通入N2一段时间,再点燃酒精喷灯加热
C. 若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性
D. 为了检验甲中残留固体中含有Fe3+,取少量固体加入稀硝酸溶解,再滴加KSCN溶液
【答案】D
【解析】
甲装置为硫酸亚铁分解的发生装置,分解后得到氧化铁、二氧化硫、三氧化硫。利用乙、丙装置检验二氧化硫和三氧化硫,用丁装置吸收尾气;
A. 乙、丙、丁中依次盛装的试剂是BaCl2溶液、品红溶液、NaOH溶液,用BaCl2溶液检验SO3,用品红溶液检验SO2,用NaOH溶液吸收尾气,故A项正确;
B.先通N2,排除装置中空气,再点燃酒精喷灯加热,防止Fe2+被氧化,故B项正确;
C.酸性KMnO4溶液具有氧化性,则SO2表现出还原性,故C项正确;
D.稀硝酸可以将亚铁离子氧化为三价铁离子,无法证明残留固体中是否含有三价铁离子,应改为稀硫酸,故D项错误;
综上,本题选D。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: _____________________________________________________________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________;计算该反应的平衡常数K=____________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________(填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________(填“升高”或“降低”),a________0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)