题目内容
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
【答案】A
【解析】
A. 实验1消耗O2为2mol-0.8mol=1.2mol,所以x=4-1.2×2=1.6,故A说法不正确;
B. 实验2消耗SO2的物质的量为4mol-0.4mol=3.6mol,所以y=2-3.6÷2=0.2,比较实验1和2,可以看出实验2反应物转化率更大,是在较低温度下进行的,因此T1>T2,故B说法正确;
C.因 T1>T2,降温平衡右移,则有K1、K2的关系:K2>K1,故C说法正确;
D. 实验1在前6 min的反应速率v (SO2)=![]() mol·L-1·min-1=0.2 mol·L-1·min-1,故D说法正确;
mol·L-1·min-1=0.2 mol·L-1·min-1,故D说法正确;
答案选A。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】化学兴趣小组用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
①称量1.0 g样品溶于水,配成250mL溶液;
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.1000 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定次数 | 待测液体积/mL | 所消耗盐酸标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 25.00 | 1.50 | 21.40 |
2 | 25.00 | 2.50 | 22.60 |
3 | 25.00 | 0.60 | 23.20 |
(1)称量时,样品应放在________称量(选填字母序号)。
a.小烧杯中 b.洁净纸片上 c.托盘上
(2)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(3)判断滴定终点到达时的现象为_______________________________。
(4)若出现下列情况,测定结果偏高的是________(选填字母序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为________。(杂质不与酸反应)。
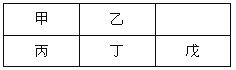
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性