题目内容
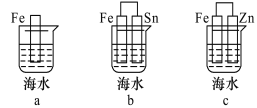
【题目】(1)下列各情况中, Fe片被腐蚀的速率由快到慢的顺序是 (填字母)。
(2)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2 = 2H2O,完成下列问题:
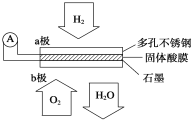
① 电子通过外电路从 极流向 极(填a或b)。
② b极上的电极反应式为: 。
③ 每转移0.1 mol电子,消耗H2的体积为 L(标准状况下)。
【答案】(1)b a c;(2)①a,b;②O2+4H++4e—=2H2O;③1.12L。
【解析】
试题分析:(1)腐蚀速率:铁作负极的原电池>化学腐蚀>作正极的原电池,a属于化学腐蚀,b属于原电池,铁比Sn活泼,作负极,c属于原电池,锌比铁活泼,铁作正极,即腐蚀速率为b>a>c;(2)①通氢气的一极为负极,通氧气的一极为正极,根据原电池工作原理,电子从负极经外电路正极,即从a流向b;②根据信息,电解质传递H+,以及基本结构图,电极反应式O2+4H++4e-=2H2O;③负极电极反应式为:H2-2e-=2H+转移0.1mol电子,消耗氢气的体积为0.1×22.4/2L=1.12L。

练习册系列答案
相关题目