题目内容
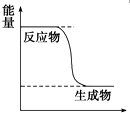
19.某可逆反应的△H=+146kJ•mol-1,下列有关该反应的叙述正确的是( )| A. | 正反应的活化能比逆反应的活化能大146 kJ•mol-1 | |
| B. | 正反应的活化能一定小于146 kJ•mol-1 | |
| C. | 逆反应的活化能一定大于146 kJ•mol-1 | |
| D. | 逆反应的活化能一定大于正反应的活化能 |
分析 根据在可逆反应过程中活化能有正反应和逆反应两种,焓变△H=正反应的活化能-逆反应的活化能;△H>0,则反应物的总能量小于生成物的总能量,为吸热反应.
解答 解:某可逆反应的△H=+146kJ•mol-1,则正反应的活化能-逆反应的活化能=+146kJ•mol-1>0,无法确定正反应、逆反应的活化能的大小,但正反应的活化能一定大于逆反应的活化能,故选A.
点评 本题主要考查了焓变与活化能的关系,需要焓变△H=正反应的活化能-逆反应的活化能,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是( )
| A. | 氧气、干冰、硫酸、烧碱 | B. | 碘酒、冰、盐酸、烧碱 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱 | D. | 铜、硫酸钠、醋酸、石灰水 |
7.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2(g)+O2(g)?2SO3(g),这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率和提高SO2的转化率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度不变 | |
| C. | 达到平衡时,v(SO2)正=v(O2)逆 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
14. 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )| A. | 负极的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ | |
| B. | H+从正极区通过交换膜移向负极区 | |
| C. | d导出的是CO2 | |
| D. | 图中b、c分别是O2、甲醇 |
4.绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想的原子经济性反应是原料分子中的原子全部转变成所需要的产物,不产生副产物,实现零排放.下列反应类型中符合要求的是( )
| A. | 置换反应 | B. | 取代反应 | C. | 分解反应 | D. | 加聚反应 |
11.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 乙醇与甲醚、分子式均为C2H6O,二者互为同分异构体 | |
| D. | 乙烯与聚乙烯不能互称为同系物 |
8.食品香精“菠萝酯”的生产路线(反应条件略去)如下.下列叙述正确的是( )
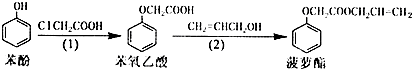
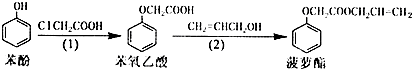
| A. | 苯氧乙酸与菠萝酯互为同系物 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
9.下列各组物质,互为同系物的是( )
| A. | CH3-CH=CH2与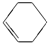 | B. | 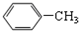 与 与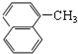 | ||
| C. | 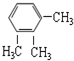 与 与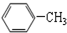 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.