题目内容
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
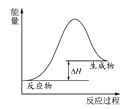
(1)用CO可以合成甲醇。
已知:①CO的燃烧热△H1=-283kJmol-1
②N2(g)+O2(g)2NO(g) △H2=+183kJmol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式________ 。
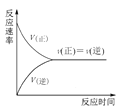
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2,在催化剂作用下发生反应:CO(g)+2H2(g)CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。
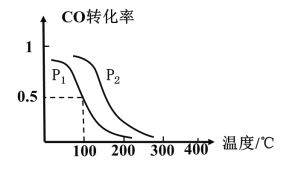
①反应的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是______ ,该反应的化学平衡常数K=____ 。
③下列说法正确的是______。
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
【答案】2NO(g)+2CO(g)=N2(g)+CO2(g) △H=-749 kJmol-1 < < 0.025molL-1s-1 K=4 B
【解析】
(1)已知:①CO的燃烧热 CO(g)+![]() O2(g)=CO2(g)△H1=-283kJmol-1;
O2(g)=CO2(g)△H1=-283kJmol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183kJmol-1;
盖斯定律计算①×2-②得到NO和CO反应生成无污染性气体的热化学反应方程式;
(2)①升高温度,一氧化碳的转化率减小,据此判定该反应的△H;温度不变时,增大压强,平衡右移,一氧化碳转化率增大,据此判定p2与p1大小;
②据图象中一氧化碳转化率,结合“三段式”进行反应速率和化学平衡常数K的计算;
③A.混合气体质量不变,气体体积不变,混合气体密度不变;
B.反应达到平衡状态时各物质的含量不变;
C.根据①中分析判断;
D.催化剂不改变平衡。
(1)已知:①CO的燃烧热 CO(g)+![]() O2(g)=CO2(g)△H1=-283kJmol-1;
O2(g)=CO2(g)△H1=-283kJmol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183kJmol-1;
盖斯定律计算①×2-②得到NO和CO反应生成无污染性气体的热化学反应方程式:2NO(g)+2CO(g)=N2(g)+CO2(g) △H=-749 kJmol-1;
(2)①升高温度,一氧化碳的转化率减小,则正反应为放热反应,反应的△H小于0;温度不变时,增大压强,平衡右移,一氧化碳转化率增大,由图可知相同温度下,p2时CO的转化率大于的p1转化率,故p1<p2;
②在容积为2L的密闭容器中充入1mol CO与2mol H2,100℃时,该反应的CO的转化率为0.5,列三段式,

则反应进行了10秒,用CO表示该反应的化学反应速率=![]() =0.025 molL-1s-1,化学平衡常数K=
=0.025 molL-1s-1,化学平衡常数K=![]() =4;
=4;
③A.容器内混合气体总质量不变,恒容气体体积不变,则密度始终不变,不能判断反应达到平衡,故A错误;
B.容器内各气体浓度恒定,是反应达到平衡状态的特征标志,故B正确;
C.根据①中分析,升高温度,一氧化碳的转化率减小,则正反应为放热反应,反应的△H<0,故C错误;
D.催化剂只改变反应速率,不影响化学平衡移动,故D错误;
答案选B。

【题目】下列实验操作、现象和结论都正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中 | 紫红色溶液变无色 | 石蜡油裂解一定产生了乙烯 |
B | 用水浸过的棉花包裹铁粉放入试管并加热,将气体通入四氯化碳溶液中 | 四氯化碳中产生气泡 | 铁粉与水蒸气在高温下一定产生了氢气 |
C | 向重铬酸钾溶液中滴加乙醇 | 橙红色溶液变绿色 | 乙醇表现出还原性 |
D | 向2ml0.1mol/L的AgNO3溶液中先滴加2滴0.1mol/L NaCl溶液,再滴入 | 先产生白色沉淀,后沉淀变成黄色 | 相同温度下,AgCl在水中的溶解度大于AgI的溶解度 |
A.AB.BC.CD.D