题目内容
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
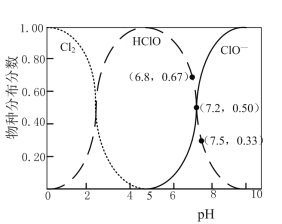
①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
【答案】-671 5NA B 4OH--4e-=O2↑+2H2O 当碱度过大时,平衡Cr2O72—+H2O![]() 2CrO42—+2H+向右移动,抑制碱度增大 HClO+H++Cl-=Cl2↑+H2O 温度过高,HClO分解速率加快,也不利于氯气的溶解 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
2CrO42—+2H+向右移动,抑制碱度增大 HClO+H++Cl-=Cl2↑+H2O 温度过高,HClO分解速率加快,也不利于氯气的溶解 2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
【解析】
根据盖斯定律求出第三个方程式的焓变,根据化合价升降得出转移电子数目;
根据生成的氯酸根的方程式中次氯酸和次氯酸根的比例得出pH值,
利用重铬酸根的平衡移动原理分析怎样防止氢氧根过量,
酸性过大,次氯酸会很快减少,主要是它们要发生反应生成氯气,
温度过高,会导致次氯酸分解。
氯酸钠是一种基础化工原料。
⑴已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,
3ClO-(aq)=ClO3- (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,
将第一个方程乘以3再加上第二个方程得到
3Cl2(g)+6OH-(aq)=ClO3-(aq)+5Cl-(aq)+3H2O(l) ΔH=-671 kJ·mol-1,根据反应方程式知6个氯原子,其中1个氯原子升高5价,另外5个氯原子降低,每个氯原子降低1价,因此该反应中生成1molClO3-,转移电子数为5NA,
故答案为:-671;5NA;
⑵①电解过程中,为按化学计量数比反应,即2HClO+ClO-=ClO![]() +2H++2Cl-反应,次氯酸根和次氯酸的比为1:2,则次氯酸占67%,因此根据图中信息应该控制电解液的pH约为6.8,
+2H++2Cl-反应,次氯酸根和次氯酸的比为1:2,则次氯酸占67%,因此根据图中信息应该控制电解液的pH约为6.8,
故答案为:B;
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为4OH--4e-= O2↑+2H2O,已知:电解时向食盐水中加入的重铬酸钠(Na2Cr2O7),当氢氧根过大时,会消耗平衡Cr2O72-+H2O![]() 2CrO42-+2H+中的氢离子,致使平衡正向移动,有效降低了氢氧根过大,
2CrO42-+2H+中的氢离子,致使平衡正向移动,有效降低了氢氧根过大,
故答案为:4OH--4e-= O2↑+2H2O;当碱度过大时,平衡Cr2O72-+H2O![]() 2CrO42-+2H+向右移动,抑制碱度增大
2CrO42-+2H+向右移动,抑制碱度增大
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是次氯酸和氯离子、氢离子三者反应生成氯气和水,其离子方程式为HClO+H++Cl-=Cl2↑+H2O,
故答案为:HClO+H++Cl-=Cl2↑+H2O;
⑶电解时须对电解槽进行冷却处理以防止电解液温度过高,次氯酸在温度较高条件下要分解,而且温度高不利于氯气的溶解,因此温度不能过高的原因是温度过高,HClO分解速率加快,也不利于氯气的溶解,
故答案为:温度过高,HClO分解速率加快,也不利于氯气的溶解;
⑷氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),氯酸钠中氯的化合价降低生成消毒剂,双氧水中氧的化合价升高变为氧气,因此该反应的化学方程式为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,
故答案为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如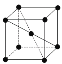 所示,1183 K以上转变为
所示,1183 K以上转变为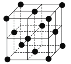 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。