题目内容
【题目】已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是
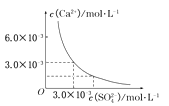
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
【答案】D
【解析】
试题分析:由图可知该条件下的CaSO4饱和溶液中溶度积常数K=9.0×10-6(mol/L)2,
c(Ca2+)=c(SO4-)=3.0×10-3mol/L,加入400mL 0.0lmol·L-l的Na2SO4溶液,
溶液体积变为500mL,c(Ca2+)=3.0×10-3mol/L/5=6.0×10-4mol/L,
c(SO42-)=(3.0×10-3mol/L×0.1L+0.01mol·L-l×0.4L)/0.5L=8.6×10-3mol/L,
所以此时c(Ca2+)·c (SO4-)=5.16×10-6(mol/L)2<9.0×10-6(mol/L)2,溶液为不饱和溶液,所以无沉淀析出,排除AC;此时c (SO4-)= 8.6×10-3mol/L>3.0×10-3mol/L,答案选D。

练习册系列答案
相关题目