题目内容
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g) ![]() 2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
2E(g)若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
A.20% B.40% C.60% D.80%
【答案】C
【解析】
试题分析:达平衡时,混合气体的压强比起始时增大了20%。根据压强之比等于物质的量之比,则有平衡时的物质的量比起始时增大了20%,即平衡后的总物质的量为2mol×(1+20%)=2.4mol。根据三段式可得:
2E(g)![]() 2M(g)+N(g)
2M(g)+N(g)
开始的物质的量 2 0 0
转化的物质的量 2x 2x x
平衡的物质的量 2-2x 2x x
即:(2-2x)+ 2x + x=2.4mol,解得x=0.4。则平衡时M的物质的量为0.8mol。因“2molM和1molN”与“2molE”互为等效平衡。则开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的物质的量也为0.8mol。即平衡时消耗M的物质的量为1.2mol,所以M的转化率为60%,答案选C。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】回答有关氯气制备的几个问题
实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有两个同学分别设计的两套实验装罝如下图:
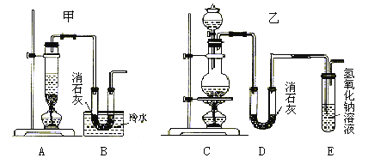
(1)写出制取氯气的离子方程式_______________________________。
(2)请从以下几个方面对甲乙两套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表格中。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染坏境。
优 点 | 缺点 | |
甲装罝 | ________ | ________ |
乙装罝 | ________ | ________ |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,请从上述装罝中选取合理的部分,组装一套较完整的实验装罝,装置各部分连接顺序是(按气流流动的方向)__________。该组合中还缺少的装罝是_____________,原因是__________________________________。
(4)实验室若用16mol/L的盐酸l00mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过__________ mol。